用高铁酸钠(Na2FeO4)对河、湖水消毒是城市饮用水处理的新技术,已知反应Fe2O3+3Na2O2=2Na2FeO4+Na2O,下列说法正确的是
| A.Na2O2既是氧化剂又是还原剂 |
| B.Fe2O3在反应中显氧化性 |
| C.3 mol Na2O2发生反应,有12 mol电子转移 |
| D.Na2FeO4能消毒杀菌是因其具有强氧化性 |
下列离子方程式正确的是
| A.向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| B.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32- |
| C.向FeCl3溶液中加入铜片:Fe3++Cu=Fe2++Cu2+ |
| D.向碳酸氢钠溶液中加入氢氧化钠:HCO3-+ OH-==CO2↑+H2O |
NA代表阿伏加德罗常数的值,下列叙述正确的是
| A.60g丙醇中存在的共价键总数为10NA |
| B.1L 0.1 mol·L-1的NaHCO3溶液中HCO3-和CO32-的离子数之和为0.1NA |
| C.钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1 NA |
D.235g核素 发生裂变反应: 发生裂变反应: + +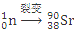 + +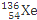 +10 +10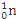 ,净产生的中子( ,净产生的中子(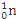 )数为10 NA )数为10 NA |
下列各组离子一定能大量共存的是
| A.在含有大量AlO2-的溶液中:NH4+、 Na+、Cl-、H+ |
| B.在强碱溶液中:Na+、K+、CO32-、NO3- |
| C.常温下,在pH=12的溶液中:Mg2+、Na+、SO42-、Cl- |
| D.在水电离出的c(H+)=1×10-13mol·L-1的溶液中:K+、I-、Cl-、NO3- |
现有两瓶溶液,新制饱和氯水和亚硫酸,下列方法或试剂(必要时可加热)能用于鉴别它们的是:①观察颜色;②石蕊试剂;③品红溶液
| A.①②③ | B.只有①③ | C.只有②③ | D.只有① |
下列情况会对人体健康造成较大危害的是
| A.自来水中通入少量Cl2进行消毒杀菌 |
| B.用SO2漂白食品 |
| C.用食醋清洗热水瓶胆内壁附着的水垢 |
| D.用小苏打(NaHCO3)发酵面团制作馒头 |