(9分) (1)水的电离平衡曲线如图所示,若A点表示25°C时水的电离达平衡时的离子浓度,B点表示100°C时水的电离达平衡时的离子浓度。
①100°C时1mol·L﹣1的NaOH溶液中,由水电离出的c(H+)= mol·L﹣1,KW(25°C)
KW(100°C)
(填“>”、“<”或“=”)。
②25°C时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是 (填“促进”“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 |
电离常数(25℃) |
| HCN |
K=4.9×l0-10 |
| CH3COOH |
K=1.8×l0-5 |
| H2CO3 |
K1=4.3×l0-7、K2=5.6×l0-11 |
③25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的pH由大到小的顺序为 。
④25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,混合后所得溶液显碱性,则c(Na+) c(CH3COO-)(填“>”、“<”或“=”)。
⑤向NaCN溶液中通入少量CO2,所发生反应的化学方程式为
。
(7分)现有部分元素的原子结构特点如下表:
| X |
L层电子数是K层电子数的3倍 |
| Y |
核外电子层数等于原子序数 |
| Z |
L层电子数是K层和M层电子数之和 |
| W |
最外层电子数是次外层电子数的2.5倍 |
(1)画出W原子结构示意图:____________。
(2)元素X与元素Z相比,非金属性较强的是______(填元素符号),写出一个能表示X、Z非金属性强弱关系的化学反应方程式:____________________________。
(3)X、Y、Z、W四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为________。
(4)元素X和元素Y以原子个数比1∶1化合形成的化合物Q,元素W和元素Y化合形成的化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的,且在自然界中稳定存在的物质,写出该反应的化学方程式:_______________。
【化学——选修5:有机化学基础】(15分)
有机化合物G是合成维生素类药物的中间体,其结构简式如图所示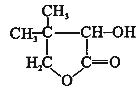
G的合成路线如下图所示: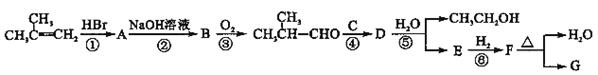
其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去
已知: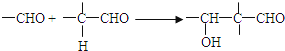
请回答下列问题:
(1)G的分子式是,G中官能团的名称是;
(2)第②步反应的化学方程式是;
(3)B的名称(系统命名)是;
(4)第②~⑥步反应中属于取代反应的有(填步骤编号);
(5)第④步反应的化学方程式是;
(6)写出同时满足下列条件的E的所有同分异构体的结构简式。
①只含一种官能团;②链状结构且无-O-O-;③核磁共振氢谱只有2种峰。
【化学——选修2:化学与技术】
技术的发展与创新永无止境,我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图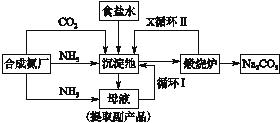
(1)向沉淀池中要通入CO2和氨气,应选通入______(填化学式)。原因是______________。
(2)沉淀池中发生反应的化学方程式是__________________________________。
(3)母液中的溶质主要是________。向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入氨气的作用是_____________________________________________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环,物质X是__________,从沉淀池中提取沉淀的操作是__________。
(5)写出煅烧炉中发生反应的化学方程式_____________________________。
(6)这样制得的产品碳酸钠中可能含有的杂质是____________(填化学式),为检验该杂 质的存在,具体操作是__________________________________________。
应用化学学科知识,回答下列问题
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g)△H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g)△H = -566.0 kJ/mol
H2O(g)=H2O(1)△H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ________。
(2)水煤气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g) △H=" +" 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g) △H=" +" 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
(3)已知A和B在一定条件下可建立如下平衡:2A(g)+B(g) 2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。
2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。
①达到平衡所需时间是ⅠⅡ(填“>”、“<”或“=”,下同)。达到平衡后,两容器中C的体积分数关系是ⅠⅡ。
②平衡时,测得容器Ⅱ中的压强减小了30%,则该容器中A的转化率为。
A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。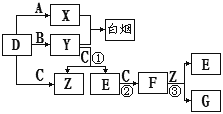
请回答下列问题:
(1)D的化学式为。
(2)写出实验室制Y的化学方程式 。
(3)反应③的离子方程式为。
(4)写出反应①的化学方程式。
(5)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为。
(6)常温下0.1 mol·L-1的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度0.1 mol·L-1
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1 mol·L-1的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH为9