铁矿石冶炼成铁是一个复杂的过程,把铁矿石和焦炭、石灰石一起加入高炉,在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。一氧化碳还原氧化铁的化学方程式为 。某化学兴趣小组同学在学习炼铁的相关内容时,对炼铁时还原剂的选择进行了如下探究。
【提出问题】
单质碳也具有还原性,碳还原氧化铁的化学方程式为 。
为什么工业上不用焦炭作为还原剂直接还原铁矿石?
【猜想与假设】焦炭和铁矿石都是固体,接触面积小,反应不易完全。
【查阅资料】氢氧化钠溶液和澄清石灰水化学性质类似,能与二氧化碳反应,但反应无明显现象。
【进行实验】实验步骤及注意事项如下:
①称取两份相同质量的氧化铁粉末。一份与足量的碳粉均匀混合放入下图装置A的试管中;另一份放入下图装置B的玻璃管中。
②装置A和B两组实验同时开始进行。在装置B的反应中,实验开始前应先 (选填“通CO”或“加热”); 实验结束后应继续通入CO直至冷却至室温,其原因是 。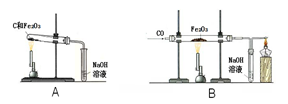
【实验现象】当装置B的玻璃管中固体完全由 时(选填“红色变为黑色”或“黑色变为红色”),装置A的试管中仍有 。
【解释与结论】焦炭和铁矿石都是固体,接触面积小,反应确实不易完全,这可能是工业上不用焦炭作为还原剂直接还原铁矿石的一个原因。
【交流与反思】经过查阅资料和讨论,该小组同学发现除了上述原因外,工业上不用焦炭作为还原剂直接还原铁矿石还有一些其它原因,试写出其中的一个: 。
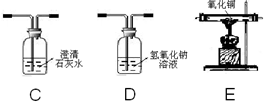
【完善实验】联想到单质碳的一些化学性质,甲同学认为在碳还原氧化铁的反应中可能还会有CO产生。为了证明碳还原氧化铁所得的气体中含有CO和CO2,将该气体通过下图的检验装置,正确的连接顺序是 (选填字母,装置可重复使用)。经过检验,证实碳还原氧化铁所得的气体中确实含有CO和CO2,因此装置A的不足之处是 。
金属材料被广泛的应用于我们的生活中,不仅是因为其物理性能优良,还与它们的化学性质密切相关。下面是小明同学设计测定金属铁、铜和镁的活动性的探究实验过程和实验记录,请你一起探究。
【实验目的】测定金属铁、铜和镁的活动性强弱
【所用试剂】稀硫酸、硝酸银溶液、光亮的薄铁片、薄铜片、薄镁片
【实验过程】步骤Ⅰ 将铁片、铜片、镁片分别在空气中点燃片刻,观察燃烧现象;
步骤Ⅱ 将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的稀硫酸的试管中;
步骤Ⅲ 将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的硝酸银溶液的试管中。
实验现象记录表
| 金属 |
空气 |
稀硫酸 |
硝酸银溶液 |
| 铁 |
- |
||
| 铜 |
- |
- |
|
| 镁 |
【实验记录】用“”表示能观察到实验现象,用“-”表示观察不到实验现象(见表)。
(1)通过步骤Ⅰ可以得出三种金属中镁的金属活动性最强,判断依据是。
(2)运用“控制变量法”设计实验方案是化学研究的重要方法。步骤Ⅱ和步骤Ⅲ中,需要控制的实验条件除了金属的体积、溶液的体积、溶质质量分数以外,还需要控制的条件是。写出镁和稀硫酸反应的化学方程式,此反应属于。
【实验结论】金属铁、铜和镁的活动性由强到弱的顺序是(用元素符号表示)。
【反思交流】若利用上述试剂制取氢气,小明认为应该选择金属铁和稀硫酸反应,而不选择金属镁和稀硫酸反应,他的理由是。
钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要。甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定。(假设每步反应均能完全进行,赤铁矿粉中杂质性质稳定,既不溶于水也不参与反应,浓硫酸可吸收水蒸气)
(1)甲组同学称取一定质量的赤铁矿粉,采用如图的装置进行实验。
①装置A中发生反应的化学方程式是。
②为充分吸收反应生成的CO2,装置B中应盛放的试剂是浓溶液。
③可以通过下面不同的方法计算赤铁矿粉中Fe2O3的含量:
【方法一】称量反应前后A装置的总质量,计算出Fe2O3的含量;
【方法二】称量得出反应生成的CO2的质量,计算出Fe2O3的含量。
(2)乙组同学称取等质量的赤铁矿粉放入烧杯中,向烧杯中加入过量的稀硫酸充分反应(氧化铁与稀硫酸反应生成硫酸铁和水),(填一个操作名称)后立即称量。根据称量的数据计算出Fe2O3的含量。
(3)甲、乙两组同学通过相互比较后对各自的实验方案进行评价。
| 方案 |
优 点 |
| 甲组 |
|
| 乙组 |
某学习小组在整理化学试剂时,发现一瓶盛有白色固体的试剂瓶,标签破损(如图)。
【提出问题】该白色固体的成分是什么?
【搜集资料】①经老师回忆,该试剂的酸根离子可能是CO32-、SO32-、SO42-、
NO3-中的一种 ②SO2是一种无色有刺激性气味的气体,密度比空气大,易溶于水,能使澄清的石灰水变浑浊,也能使品红溶液褪色,而CO2不能使品红溶液褪色。
【猜想假设】该试剂一定不是,可能是Na2CO3,也可能是或。
【实验探究】
| 实验操作 |
现 象 |
结 论 |
| 取少量白色固体加入适量盐酸 |
产生气泡 |
该白色固体不可能是 |
| 产生的气体通入澄清石灰水 |
石灰水变浑浊 |
该白色固体不可能是 |
| 产生的气体通入品红溶液 |
溶液褪色 |
【获得结论】该白色固体是。
【交流反思】
(1)SO2和CO2均属于非金属氧化物,某些性质相似。请写出下列化学反应方程式:
SO2通入澄清石灰水;
SO2通入紫色石蕊试液,试液变红色。
(2)亚硫酸钠与盐酸反应能生成SO2,实验室中收集SO2的方法为,
检验SO2的试剂为。
某化学小组参观制碱厂后,绘制了该厂生产纯碱的工艺流程图如下,据图回答:
(1)流程Ⅰ是依次向粗盐水中加入Ca(OH)2和Na2CO3,二者加入的顺序能否颠倒?为什么?。
(2)用一个化学反应方程式表示出流程Ⅱ中发生的总反应。
(3)如果不将氯化铵作为目标产品,即加入氨气不是为了生产出氯化铵,那么,氨气在制碱过程中的作用是。
(4)工业生产纯碱的流程中,碳酸化时溶液中析出碳酸氢钠而没有析出氯化铵的原因是。
在初中化学中,我们学习了溶液的有关知识。如图是KNO3的溶解度曲线。
(1)从图中溶解度曲线可以得到的信息是(写一条)。
(2)小明参照图示在常温20 ℃时进行了如下实验:
小明观察到A中所加固体全部溶解,则B中的现象是。上述实验过程中属于不饱和溶液的是(填字母)。D中溶液的溶质质量分数是。