粉末状样品A是由等物质的量的MgO和Al2O3与常见金属氧化物B组成的混合物。A有如下图所示的转化关系。
请完成下列问题:
(1)单质C和H的化学式分别是__________、__________。
(2)写出由I生成J的离子方程式:_____________________________________
(3)写出由F生成G的离子方程式________________________________________
(4)若10.7 g样品A中MgO、Al2O3和B的物质的量均为0.05 mol,则B的化学式为_________。
如图为五个椭圆交叉构成的图案,椭圆内分别写C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号.请回答下列问题: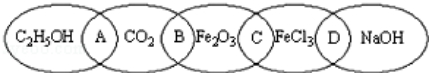
(1)两种物质都是氧化物的是 (填分类标准代号,下同).
(2)分类标准代号A表示
a.两物质都可作燃料 b.两物质都是有机物
c.两物质都是含碳化合物 d.两物质都是氧化物
(3)分类标准代号C物质中的某一物质能与某种强酸反应生成同组物质中的另一种物质,该反应的化学方程式为
(4)图中相连的两种物质可归为一类,又能相互反应的是 (填分类标准代号),其反应的基本类型是 反应.
(5)用洁净的烧杯取25mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热呈红褐色,得到的分散系称为 ,该分散系能发生 现象。
目前,世界各国主要采用电解熔融氯化钠的方法生产金属钠: 2NaCl (熔融)=2Na + Cl2↑。现有如下转化关系: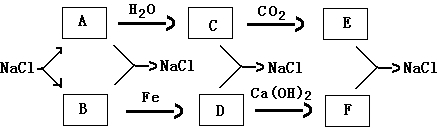
(1)写出下列化学方程式:
A+H2O→C:
C+D→NaCl:
E+F→NaCl:
(2)通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用C物质溶液吸收,其化学方程式
为 。
(3)将A投入CuSO4的溶液中,观察到溶液中除了有气泡产生,甲同学认为还有红色铜生成,乙同学认为还有蓝色的Cu(OH)2生成。你支持 同学的观点,理由是
一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物。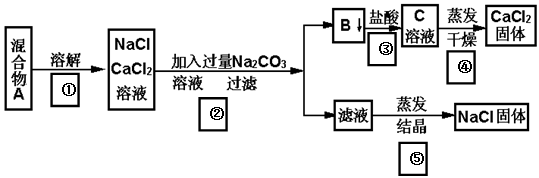
填空和回答下列问题:
(1)B物质是 (写化学式)。
(2)按此实验方案分离得到的NaCl,经分析含有杂质,是因为上述方案中第 步(填序号)设计存在问题,这一步的正确设计方案应是 ;有关反应的离子方程式为 。
(3)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是_____________。
图1是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。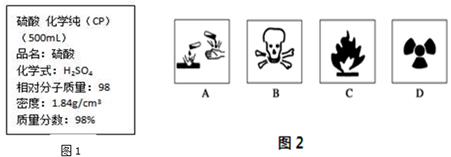
Ⅰ.(1)在盛放浓硫酸的试剂瓶的标签上应印有图2警示标志中的____________。
(2)若将该浓硫酸与等质量的水混合,则所得溶液中溶质物质的量浓度_________9.2mol/L(填>、<、=)。
Ⅱ.现欲用该浓硫酸配制成1mol/L的稀硫酸,现实验室仅需要这种稀硫酸220mL。试回答下列问题:
(3)用量筒量取该浓硫酸______________ mL。
(4)配制时,必须使用的仪器除量筒、烧杯外,还缺少的仪器是_________________。
(5)若在稀释过程中,浓硫酸不慎沾在手上,处理方法为 。
(6)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是____________。
| A.用量筒量取浓硫酸时俯视 |
| B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中 |
| C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中 |
| D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切 |
E.容量瓶不干燥
F.定容时,俯视容量瓶刻度线
现有如下九种物质:①H2 ②铝 ③CuO ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3 ⑩NaHSO4
(1)按物质的分类方法,将上述物质的序号填入表格的空白处:
| 分类标准 |
能导电 |
电解质 |
非电解质 |
| 属于该类的物质 |
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH- H2O,该离子反应对应的化学方程式为 。
H2O,该离子反应对应的化学方程式为 。
(3)⑨的电离方程式为 。将34.2g ⑨冷却后溶于水配成250mL溶液,SO42-的物质的量浓度为 。
(4)②与⑧发生反应的化学方程式为:Al + 4HNO3(稀)= Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是 (填化学式),还原剂与氧化剂的物质的量之比是 ,当有5.4g Al发生反应时,转移电子的物质的量为 。