下列有关氯水的叙述正确的有( )
| A.新制氯水中只有Cl2和H2O分子 |
| B.氯气跟水反应生成两种强酸 |
| C.光照氯水时有气体逸出,该气体是Cl2 |
| D.新制氯水放置数天后酸性会变强 |
在一个固定体积的密闭容器中,加入2molA和1molB,发生反应:2A(气) + B(气)  3C(气) + D(气)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为Wmol/L的是 ( )
3C(气) + D(气)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为Wmol/L的是 ( )
| A. 4molA+2molB | B. 2molA+1molB+3molC+1molD |
| C. 3molC+1molD+1molB | D. 3molC+1molD |
下列依据热化学方程式得出的结论正确的是()
A.已知2SO2(g)+O2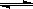 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量 |
| B.已知C(石墨,s)==C(金刚石,s) △H>0,则金刚石比石墨稳定 |
C.已知H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/ mol,则任何酸碱中和反应的热效应均为57.3 kJ mol,则任何酸碱中和反应的热效应均为57.3 kJ |
| D.已知2C(s) +2O2 (g) ==2CO2(g) △H12C(s) +O2 (g) ==2CO (g)△H2则△H1<△H2 |
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是 ( )
| A.C(s)+O2(g)=CO(g) △H =" ―393.5" kJ/mol |
| B.2H2(g)+O2(g)=2H2O(l) △H =" +571.6" kJ/mol |
C.CH4(g)+2O2(g)=CO2(g) +2H2O(g) △H =" ―890.3" kJ/mol +2H2O(g) △H =" ―890.3" kJ/mol |
| D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H =" ―2800" kJ/mol |
已知:P4(s、白磷)+5O2(g)= P4O10(s)△H =" -2983.2" kJ / mol
4P(s、红磷)+5O2(g)= P4O10(s)△H =" -2954" kJ / mol
那么,1mol红磷转变成相应物质的量白磷时,应是 ( )
| A.吸收29.2kJ热量 | B.放出29.2kJ热量 |
| C.放出7.3kJ热量 | D.吸收7.3kJ热量 |
下列措施肯定使化学反应速率增大的是 ()
| A.增大反应物的量 | B.增加压强 | C.升高温度 | D.使用催化剂 |