将40mL 1.5 mol/L的CuSO4溶液与30mL 3 mol/L的NaOH溶液混合,生成浅蓝色沉淀,假如溶液中c(Cu2+)或c(OH-)都已变得很小,可忽略,则生成沉淀的组成可表示为( )
| A.Cu(OH)2 | B.CuSO4·Cu(OH)2 |
| C.CuSO4·2Cu(OH)2 | D.CuSO4·3Cu(OH)2 |
下列说法错误的是( )
| A.化石燃料在任何条件下都能燃烧 |
| B.化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体 |
| C.直接燃烧煤不如将煤进行深加工后再燃烧的效果好 |
| D.固体煤变为气态燃料后,燃料效率将更低 |
某些化学试剂可用于净水。水处理中使用的一种无机高分子混凝剂的化学式可表示为[Al2(OH)nClm·yH2O]x,式中m等于( )
| A.3-n | B.6-n | C.6+n | D.3+n |
铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。Tl3+与Ag在酸性介质中发生反应:Tl3++2AgTl++2Ag+。下列推断正确的是( )
| A.Tl+的最外层有1个电子 |
| B.Tl3+的氧化性比Al3+弱 |
| C.Tl能形成+3价和+1价的化合物 |
| D.Tl+的还原性比Ag强 |
某500 mL溶液中含0.1 mol Fe2+、0.2 mol Fe3+,加入0.2 mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变) ( )
| A.0.4 mol·L-1 | B.0.6 mol·L-1 |
| C.0.8 mol·L-1 | D.1.0 mol·L-1 |
有六种溶液,分别含有下列阳离子:Cu2+、Fe2+、Fe3+、Al3+、NH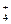 、Na+,只选用一种试剂将它们一一鉴别,该试剂可以是( )
、Na+,只选用一种试剂将它们一一鉴别,该试剂可以是( )
| A.AgNO3溶液 | B.KMnO4溶液 |
| C.稀氨水 | D.NaOH溶液 |