T1℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据如下表:
CO2(g)+H2(g),反应过程中测定的部分数据如下表:
| 反应时间/min |
n(CO)/mol |
n(H2O)/mol |
| 0 |
1.20 |
0.60 |
| 10 |
0.80 |
|
| 20 |
|
0.20 |
下列说法正确的是
A.反应在10min内的平均速率为v(H2)=0.04mol · L-1 · min-1
B.保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 mol H2O,达到平衡时n(CO2)= 0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升高至T2℃(T2>T1)时,上述反应平衡常数为0.64,则正反应为吸热反应
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(g) + B(g) 2C(g) 若经 2 s 后测得 C 的浓度为 0.6 mol/L;现有下列几种说法:①用物质 A 表示的反应的平均速率为 0.3 mol/(L·s)②用物质 B 表示的反应的平均速率为 0.6 mol/(L · s)③ 2 s 时物质 A 的转化率为 70 %④ 2 s 时物质 B 的浓度为 0.7 mol/L 其中正确是
2C(g) 若经 2 s 后测得 C 的浓度为 0.6 mol/L;现有下列几种说法:①用物质 A 表示的反应的平均速率为 0.3 mol/(L·s)②用物质 B 表示的反应的平均速率为 0.6 mol/(L · s)③ 2 s 时物质 A 的转化率为 70 %④ 2 s 时物质 B 的浓度为 0.7 mol/L 其中正确是
| A.①③ | B.①④ | C.②③ | D.③④ |
某同学按如下图所示的装置进行实验。A、B为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42一从右向左移动。下列分析正确的是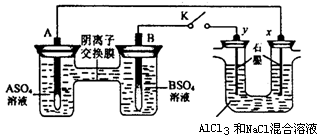
A.溶液中c(A2+)减小
B.B的电极反应:B-2e- =B2+
C.y电极上有H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,一段时间以后沉淀逐渐溶解
80℃时,2L密闭容器中充入0.40molN2O4,发生反应N2O4 2NO2 △H=+QkJ·mol-1(Q>0) ,获得如下数据:
2NO2 △H=+QkJ·mol-1(Q>0) ,获得如下数据:
| 时间/s |
0 |
20 |
40 |
60 |
80 |
100 |
| c(NO2)/mol·L-1 |
0.00 |
0.12 |
0.20 |
0.26 |
0.30 |
0.30 |
下列判断正确的是
A.升高温度该反应的平衡常数K减小
B.20—40s内,v(N2O4)=0.004mol/(L·s)
C.反应达平衡时,吸收的热量为0.30QkJ
D.100s时再通入0.40molN2O4,达新平衡时N2O4的转化率增大
Al-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说法正确的是
| A.当电极上析出0.54 g Ag时,电路中转移的电子为0.01 mol |
B.该隔膜是阳离子交换膜 |
| C.Al电极的反应式为:Al-3e-+3OH-=Al(OH)3 |
| D.正极的电极反应式为:AgO+2e-+2H+=Ag+H2O |
一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是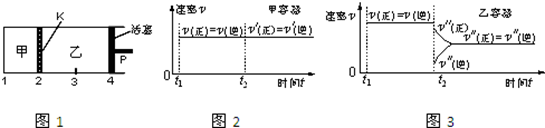
| A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中 C的浓度的2倍 |
| B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 |
| C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
| D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |