在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是
A.溶质的质量分数为w=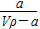 ×100% ×100% |
| B.溶质的物质的量浓度c=1000a/17a mol·L-1 |
| C.溶液中c(OH-)=1000b/V mol·L-1 |
| D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |
在25mL 0.1mol·L-1NaOH溶液中逐滴加入0. 2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾为电解质,电池总反应式为Zn(s) + 2MnO2(s) + H2O(l) = Zn(OH)2(s) +Mn2O3(s),下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
草酸(H2C2O4)是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol•L-1 NaHC2O4溶液中滴加0.01 mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)=0时,c(H+)=1×10-2 mol•L-1 |
| B.V(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L |
D.V(NaOH)>10 mL 时,c(Na+)>c(C2O42-)>c(HC2O4-) 时,c(Na+)>c(C2O42-)>c(HC2O4-) |
已知25℃、101kPa条件下:4Al (s) + 3O2 (g) ==2Al2O3 (s)△H = -2834.9 kJ·mol -1
-1
4Al (s) +2O3 (g) ==2Al2O3 (s)△H = -3119.91 kJ·mol-1,由此得出的结论正确的是
| A.等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B.等质量的O2比O3能量低,由O2变O3为放热反应 |
| C.O3比O2稳定,由O2变O3为吸热反应 |
| D.O2比O3稳定,由O2变O3为放热反应 |
将 lmolSO2和 l mol O2通入体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡时 SO3为0.3mol,若此时移走 0.5mol O2和 0.5mol SO2则反应达到新的平衡时,SO3的物质的量是
| A.0.3mol | B.0.15mol |
| C.小于 0.15mol | D.大于0.15mol而小于 0.3mol |