已建立平衡的可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
①生成物的百分含量一定增加; ②生成物的产量一定增加;
③反应物的转化率一定增加; ④反应物物质的量浓度一定减小;
⑤正反应速率一定大于逆反应速率; ⑥使用了催化剂
| A.①② | B.②⑤ | C.③⑤ | D.③④⑥ |
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。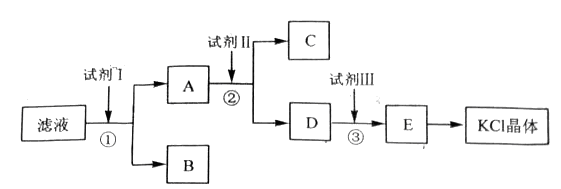
回答下列问题:
(1)起始滤液的pH_____7(填“大于”“小于”或“等于”),其原因是______________________________;(用离子方程式表示)
(2)试剂Ⅰ的化学式为___________,①中发生反应的离子方程式为_______________;
(3)试剂Ⅱ的化学式为____________,②中加入试剂Ⅱ的目的是__________________;
(4)试剂Ⅲ的名称是_____________,③中发生反应的离子方程式为________________;
v L Fe2(SO4)3溶液中含有a g SO42-,取此溶液0.5v L,用水稀释至2v L,则稀释后溶液中Fe3+的物质的量浓度为
A.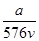 mol·L-1 mol·L-1 |
B.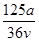 mol·L-1 mol·L-1 |
C.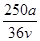 mol·L-1 mol·L-1 |
D.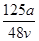 mol·L-1 mol·L-1 |
某地甲、乙两厂排放的污水中各含有下列8种离子中的4种(两厂废水所含离子不同):Ag+、Ba2+、Fe2+、Na+、Cl-、SO42-、NO3-、OH-。若两厂单独排放污水都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便能变得无色澄清,溶质主要含硝酸钠,污染程度大大降低。根据所给信息有以下几种说法,你认为正确的是
| A.Na+和NO3-来自同一工厂 | B.Cl-和NO3-一定来自同一工厂 |
| C.Ag+和Na+可能来自同一工厂 | D.SO42-和OH-一定来自同一工厂 |
能实现下列物质间直接转化的元素是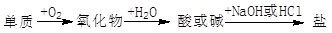
| A.硅 | B.硫 | C.铜 | D.铁 |
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是
| 选项 化合物 |
A |
B |
C |
D |
| Y |
Cu2S |
Fe2O3 |
C2H5OH |
FeCl3 |
| W |
Cu |
Al2O3 |
C2H5ONa |
CuCl2 |