NaH是离子化合物,与水反应可生成碱和氢气。现有NaH与Al粉混合物共mg,跟足量水反应共收集到氢气的质量为ng,则原混合物中Al粉的质量可能为
| A.(12n-m)g | B.(24m-5n)g | C.(36n-3m)g | D.(m-24n/5)g |
将V1 ml 1.0 mol/L HCl溶液和V2 ml未知浓度的NaOH溶液混合均匀后测量并记录溶液的温度,实验结果如图所示(实验中始终保持V1+V2="=50" ml)。下列叙述中不正确的是
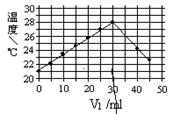
| A.当V1="=30" ml时,盐酸和NaOH溶液恰好完全反应 |
| B.NaOH溶液的浓度约为1.5 mol/L |
| C.做该实验时环境温度为22℃ |
| D.该实验表明化学能可以转化为热能 |
用 溶液完全中和pH=3的下列溶液各100mL需NaOH溶液体积最大的是()
溶液完全中和pH=3的下列溶液各100mL需NaOH溶液体积最大的是()
| A.硫酸氢钠 | B.硫酸 | C.氢氟酸 | D.氯酸 |
用蒸馏水稀释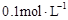 的醋酸至
的醋酸至 ,稀释过程中温度维持25℃不变,下列各项中始终保持增大趋势的是()
,稀释过程中温度维持25℃不变,下列各项中始终保持增大趋势的是()
A.c(H+) c(OH— ) c(OH— ) |
B.c(H+) | C. |
D. |
相同温度下,两个恒压且压强相同的密闭容器中发生可逆反应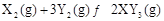

实验测得反应在起始及达到平衡时的有关数据如下表所示:
| 容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
0.1 |
0.3 |
0 |
4.63 kJ |
| ② |
0.8 |
2.4 |
0.4 |
Q(Q>O)kJ |
下列叙述正确的是()
A.反应的平衡常数:①>②
B.达平衡时,两个容器中XY3的物质的量浓度均为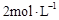
C.若容器①体积为0.20L.则达平衡时放出的热量大于4.63kJ
D.达到平衡时,容器①、②中各物质的百分含量相同
在298K、100kPa时,已知: 2H2O(g)=O2(g)+2H2(g) △H1
Cl2(g)+H2(g)="2HCl(g)" △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3
则△H3与△H1和△H2间的关系正确的是( )
| A.△H3=△H1+2△H2 | B.△H3=△H1+△H2 |
| C.△H3=△H1-△H2 | D.△H3=△H1-△H2 |