用标准氢氧化钠溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作会导致实验结果偏高的是
| A.配制标准溶液的氢氧化钠中混有碳酸钠 |
| B.滴定终点读数时,俯视滴定管的读数,其它操作均正确 |
| C.盛装未知液的锥形瓶用蒸馏水洗过,没用未知液润洗 |
| D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L﹣1 HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是
| A.a曲线表示的离子方程式为:AlO2﹣+H++H2O═Al(OH)3↓ |
| B.b和c曲线表示的离子反应是相同的 |
| C.M点时,溶液中沉淀的质量为3.9g |
| D.原混合溶液中的CO32﹣与AlO2﹣的物质的量之比为1:2 |
在25℃、1.01×105Pa下,将22g CO2通入到750mL 1.0mol•L﹣1的NaOH溶液中充分反应,放出x kJ热量.在该条件下1molCO2通入到2L 1.0mol•L﹣1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为
| A.CO2(g)+NaOH(aq)=NaHCO3(aq)△H=﹣(2y﹣x) kJ•mol﹣1 |
| B.CO2(g)+NaOH(aq)=NaHCO3(aq)△H=﹣(4x﹣y) kJ•mol﹣1 |
| C.CO2(g)+NaOH(aq)=NaHCO3(aq)△H=﹣(2x﹣y) kJ•mol﹣1 |
| D.CO2(g)+NaOH(aq)=NaHCO3(aq)△H=﹣(8x﹣2y) kJ•mol﹣1 |
已知2Fe3++2I-=2Fe2++I2、Br2+2Fe2+=2Fe3++2Br-。现向含有FeBr2、FeI2的某溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是
①按Br2、Fe3+、I2的顺序氧化性逐渐减弱
②原溶液中Br-一定被氧化
③通入氯气后原溶液中的Fe2+一定被氧化
④不能确定通入氯气后的溶液中是否还存在Fe2+
⑤若取少量所得溶液,加入CCl4后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br-均被完全氧化
| A.①②③④ | B.①③④⑤ | C.②④⑤ | D.①②③④⑤ |
在实验室中常以草酸钠(Na2C2O4)为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的化学方程式为: C2O42—+MnO4—+H+—→Mn2++CO2↑+H2O。下列有关草酸钠滴定高锰酸钾实验的叙述,正确的是
| A.滴定过程中,高锰酸钾被氧化,草酸钠被还原 |
| B.用酸式滴定管量取草酸钠溶液 |
| C.该反应中,消耗的草酸钠与高锰酸钾的物质的量之比为5:2 |
| D.为便于滴定终点的判断,滴定时必须往体系中加入指示剂 |
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法不正确的是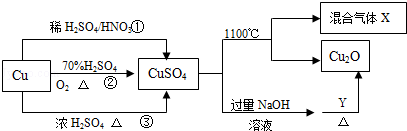
| A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 |
| B.相对于途径①、③,途径②更好地体现了绿色化学思想 |
| C.1mol CuSO4在1100℃所得混合气体X中O2可能为0.75mol |
| D.Y可能是葡萄糖 |