下列实验设计及其对应的离子方程式均正确的是( )
| A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ |
| B.Na2O2与H2O反应制备O2:Na2O2+H2O = 2Na++2OH-+O2↑ |
| C.将氯气溶于水制备次氯酸:Cl2+H2O = 2H++Cl-+ClO- |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO+6H++5H2O2= 2Mn2++5O2↑+8H2O |
向硫酸铜溶液中通入足量NH3后可得到深蓝色溶液[溶质为Cu(NH3)4SO4],再向所得溶液通入SO2至溶液呈微酸性发现有白色沉淀Q生成,反应方程式为:①2Cu(NH3)4SO4+3SO2+4H2O=2NH4CuSO3↓+3(NH4)2SO4。再将Q与足量的10mol/L硫酸混合微热,则会发生如下反应:②2NH4CuSO3+2H2SO4=Cu+(NH4)2SO4+2SO2+CuSO4+2H2O。下面有关分析中正确的是()
A.①是非氧化还原 反应,而②是氧化还原反应 反应,而②是氧化还原反应 |
| B.上述反应中SO2的作用只相当于催化剂 |
| C.反应②中CuSO4是氧化产物 |
| D.反应①中SO2发生还原反应 |
已知在pH为4~5的环境中,Cu2+、Fe2+几乎不水解,而Fe3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸气加热到80℃左右,再慢慢加入粗氧化铜(含少量杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法中可行的是()
| A.加入纯Cu将Fe2+还原为Fe |
| B.向溶液中通入H2S使Fe2+沉淀 |
| C.向溶液中通入Cl2,再通入NH3,调节pH值为4~5 |
| D.向溶液中通入Cl2,再加入纯净的CuO粉末调节pH值为4~5 |
对水的电离平衡不产生影响的粒子是( )
A.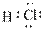 |
B.26M3+ | C.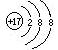 |
D.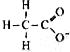 |
干燥剂的干燥性能可用干燥效率(1m3空气中实际余留水蒸气的质量)来衡量。某些干燥剂的干燥效率数据如下:
| 物 质 |
MgO |
CaO |
ZnCl2 |
ZnBr2 |
| 干燥效率 |
0.008 |
0.2 |
0.8 |
1.1 |
根据以上数据,下列有关叙述错误的是()
A.MgO的干燥性能比CaO好
B.干燥效率可能与干燥剂的阴、阳离子的半径大小有关
C.MgCl2可能是比CaCl2更好的干燥剂
D.上述干燥剂中阳离子对干燥性能的影响比阴离子小
用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe  H2
H2 Cu,②CuO
Cu,②CuO  CuSO4
CuSO4  Cu。
Cu。
若实验过程中,根据一般的实验方法和实验操作规则进行操作,则两者制得单质铜的量作比较正确的是()
| A.相等 | B.①多 | C.②多 | D.无法判断 |