在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定原溶液中含有的阳离子是( )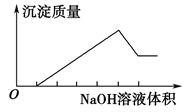
| A.Mg+、Al3+、Fe2+ | B.H+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ | D.只有Mg2+、Al3+ |
下列变化不能用勒夏特列原理解释的是
| A.向H2S水溶液中加入NaOH有利于S2-增多 |
| B.H2、I2、HI混合气体加压后颜色变深 |
| C.合成氨时将氨液化分离,可提高原料的利用率 |
| D.新制氯水久置后颜色变浅 |
某温度下,N2O4(g) 2 NO2(g);△H>0。在密闭容器中达到平衡,下列说法不正确的是
2 NO2(g);△H>0。在密闭容器中达到平衡,下列说法不正确的是
| A.加压时(减小体积),将使正、逆反应速率增大,平衡向逆反应方向移动 |
| B.保持体积不变,加入少许NO2,将使正反应速率减小,逆反应速率增大,平衡向逆反应方向动 |
| C.保持体积不变,加入少许N2O4,再达到平衡时,颜色变深 |
| D.保持体积不变,升高温度,再达平衡时颜色变深 |
反应 PCl5(g) PCl 3(g)+Cl2(g)①
PCl 3(g)+Cl2(g)①
2HI(g) H2(g)+I2(g)②
H2(g)+I2(g)②
2NO2(g) N2O4(g)③
N2O4(g)③
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率
| A.均不变 | B.均增大 |
| C.①增大,②不变,③减少 | D.①减少,②不变,③增大 |
在一密闭容器中,CO和H2O混合加热到850℃达到下列平衡:
CO(g)+H2O(g) CO2(g)+H2(g),K=1.0,若反应开始时CO和H2O的浓度分别为0.20 mol/L和1.00 mol/L,则CO转化为CO2的转化率为
CO2(g)+H2(g),K=1.0,若反应开始时CO和H2O的浓度分别为0.20 mol/L和1.00 mol/L,则CO转化为CO2的转化率为
| A.5% | B.80% | C.83% | D.91% |
把 a mol X和 b mol Y充入一密闭容器中,发生反应X(g)+2 Y(g) 2 Z(g),达到平衡时,若它们的物质的量满足:n(X)+n(Y)= n(Z),则Y的转化率为
2 Z(g),达到平衡时,若它们的物质的量满足:n(X)+n(Y)= n(Z),则Y的转化率为