A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为 。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则 ①C的化学式为 。
②反应B+A→C的离子方程式为 。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D为 (填化学式),此时图b中x 7(填“﹥”“﹤”“﹦”)
②若图c符合事实,则其pH变化的原因是 (用离子方程式表示);
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式: 。
乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平。结合以下路线回答:
已知:
(1)上述过程中属于物理变化的是__________(填序号)。
①分馏②裂解
(2)A的官能团是__________。
(3)反应II的化学方程式是__________。
(4)D为高分子化合物,可以用来制造多种包装材料,其结构简式是__________。
(5)E是有香味的物质,在实验室可用下图装置制取。
①反应IV的化学方程式是__________。
②出于对安全的考虑,实验中应该采取的措施是__________。(写出一种即可)
(6)下列关于CH2=CH-COOH的说法正确的是__________。
①与CH3CH=CHCOOH互为同系物
②可以与NaHCO3溶液反应放出CO2气体
③在一定条件下可以发生取代、加成、氧化反应
①~⑧是元素周期表中的部分元素。
 族 族周期 |
IA |
0 |
||||||
| 1 |
① |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
请回答:
(1)元素③④⑧的气态氢化物中最稳定的是__________(填化学式)。
(2)元素⑤和⑦的最高价氧化物对应水化物反应的离子方程式是__________。
(3)元素⑥和⑧形成的化合物的电子式是__________。
(4)某同学为了比较元素②和硅元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。请回答:
a. X是__________(填化学式),B装置的作用是__________。
b. 能说明元素②和硅元素非金属性强弱的实验现象是__________,相关的化学方程式是__________。同主族元素从上到下__________,得电子能力逐渐减弱,非金属性逐渐减弱。
(5)请设计实验比较元素⑥与⑦金属性的相对强弱__________。
为了研究外界条件对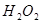 分解反应速率的影响,某同学在四支试管中分别加入
分解反应速率的影响,某同学在四支试管中分别加入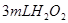 溶液,并测量收集
溶液,并测量收集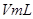 气体所需的时间,实验记录如下:
气体所需的时间,实验记录如下:
| 实验序号 |
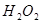 溶液浓度 溶液浓度 |
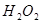 溶液温度 溶液温度 |
催化剂 |
所用时间 |
| ① |
5% |
20℃ |
2滴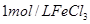 |
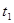 |
| ② |
5% |
40℃ |
2滴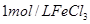 |
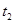 |
| ③ |
10% |
20℃ |
2滴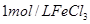 |
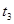 |
| ④ |
5% |
20℃ |
不使用 |
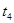 |
请回答:
(1)过氧化氢分解的化学方程式是__________。
(2)实验①②是研究__________对反应速率的影响。
(3)实验测得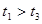 ,原因是__________。
,原因是__________。
(4)实验①④的测定过程如下图,曲线a对应的实验序号是__________(填“①”或“④”)。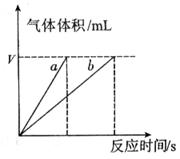
聚合物 的合成路线如下:
的合成路线如下:
(1)在合成 的反应路线中:
的反应路线中:
①生成A的反应类型是。
②由B生成 的化学方程式是。
的化学方程式是。
③聚合物 的结构简式是。
的结构简式是。
(2) 的结构简式是。
的结构简式是。
(3)①D的名称是。
②写出生成 的化学方程式。
的化学方程式。
(4)在合成 的反应路线中:
的反应路线中:
①H的分子式是 ,写出
,写出 的化学方程式。
的化学方程式。
②下列说法正确的是。
a. 乙烯与H互为同系物
b. H的同分异构体中存在芳香烃
c. N分子中可能存在碳碳双键
d. H→N的反应原子利用率是100%
工业上常用天然气作为制备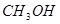 的原料。已知:
的原料。已知:
①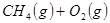
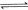
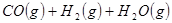
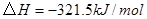
②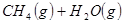
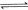
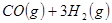
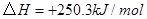
③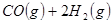
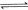
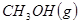
(1)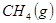 与
与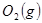 反应生成
反应生成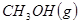 的热化学方程式为。
的热化学方程式为。
(2)向VL恒容密闭容器中充入 与
与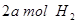 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。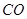 的平衡转化率与温度、压强的关系如下图所示:
的平衡转化率与温度、压强的关系如下图所示: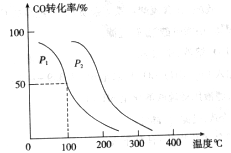
①压强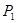
 (填“<”、“>”或“=”)
(填“<”、“>”或“=”)
②在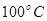 、
、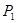 压强时,平衡常数为(用含
压强时,平衡常数为(用含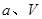 的代数式表示)。
的代数式表示)。
(3)下图是甲醇燃料电池(电解质溶液为稀硫酸)结构示意图,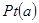 电极通入的
电极通入的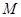 为,电极反应式是。
为,电极反应式是。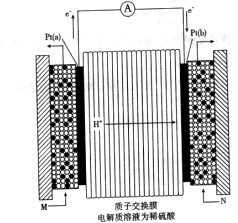
若用该电池电解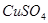 溶液,当得到
溶液,当得到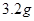 铜时,参加反应的气体
铜时,参加反应的气体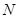 的体积应为
的体积应为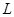 (标准状况)。
(标准状况)。