以NA为阿伏加德罗常数的值,下列说法正确的是:
| A.标准状况下,22.4L任意比混合的H2和CO2的气体中含有的分子总数均为NA |
| B.水的摩尔质量等于NA个水分子的相对分子质量之和 |
| C.标准状况下,5.6L四氯化碳含有的分子数为0.25NA |
| D.分别由NA个水分子组成的冰、水、水蒸气的质量各不相同 |
下列各项中“操作或现象”能达到预期“实验目的”的是
| 选项 |
目 的 |
操作或现象 |
| A |
制备无水FeCl3 |
将FeCl3溶液加热蒸干 |
| B |
除去KNO3中少量NaCl |
将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C |
证明非金属性Cl>C>Si |
向碳酸钠溶液中加盐酸产生气体,将气体先通过饱和NaHCO3溶液,再通入硅酸钠溶液时产生白色沉淀 |
| D |
测定NaCl中混有Na2CO3的量 |
取一定量样品加入足量稀硫酸,将产生的气体直接用足量碱石灰吸收,测得其增重,便可求得原样品中Na2CO3的量 |
完成下列实验所选择的装置或仪器(夹持装置部分已略去)正确的是
| A |
B |
C |
D |
|
| 实 验 |
分离Na2CO3溶液和CH3CH2OH |
除去Cl2中含有的少量HCl |
做Cl2对NaOH溶液的喷泉实验 |
制取少量氨气 |
| 装 置 或 仪 器 |
 |
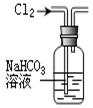 |
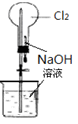 |
 |
近年来化学科学家采用“组合转化”技术,将二氧化碳在一定条件下转化为重要的化工原料乙烯:2CO2(g)+6H2(g)  C2H4(g)+4H2O(g);△H=+1411.0 kJ/mol,关于该反应,下列图示与对应的叙述相符的是
C2H4(g)+4H2O(g);△H=+1411.0 kJ/mol,关于该反应,下列图示与对应的叙述相符的是
| A.图1表示该反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示一定条件下反应达到平衡后改变压强反应物的转化率的变化 |
| C.图3表示一定条件下反应达到平衡后改变温度反应平衡常数的变化 |
| D.图4 表示一定条件下反应达到平衡后改变温度、压强产物百分含量的变化 |
用铂作电极电解1000 mL 0.1 mol/L AgNO3溶液,通电一段时间后关闭电源,测得溶液的质量减少了13.4 g。下列有关叙述正确的是(NA代表阿伏加德罗常数的值)
| A.电解过程中流经外电路的电子数目为0.1NA |
| B.在标准状况下,两极共产生3.92L气体 |
| C.电解后溶液的pH为2(假设溶液体积不变) |
| D.加入13.8 g Ag2CO3可将溶液彻底复原 |
下列解释事实的离子方程式不正确的是
| A.酸性KMnO4溶液与H2O2反应:2MnO4-+5H2O2+6H+= 2Mn2++5O2↑+8H2O |
| B.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| C.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
| D.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ |