下列离子反应方程式正确的是
| A.Na2O2与水反应:2O22- + 2H2O = 4OH- + O2↑ |
| B.NaHCO3与盐酸:CO32- + 2H+ = H2O + CO2↑ |
| C.Ca(HCO3)2与过量的NaOH溶液反应:Ca2+ + 2HCO3- + 2OH- = CaCO3↓+ CO32- +2H2O |
D.醋酸与小苏打溶液反应H++HCO3-= CO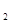 ↑+H2O ↑+H2O |
安全大于天,对下列事故处理方法正确的是
| A.汽油失火时,立即用水灭火 |
| B.电线短路失火时,可立即用泡沫灭火器灭火 |
| C.浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤 |
| D.浓 NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上硼酸溶液 |
下列各组选项按电解质、非电解质、单质和混合物顺序排列的一组是
| A.HCl、SO3、石墨、液氧 |
| B.蔗糖、CuSO4、氮气、波尔多液 |
| C.NaCl、乙醇、铁、空气 |
| D.KCl、NaNO3、氯气、石灰水 |
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是
| A.溶质的电离方程式为NaHCO3=Na++ H++ CO32- |
| B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大 |
| C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| D.温度升高,c(HCO3-)增大 |
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示: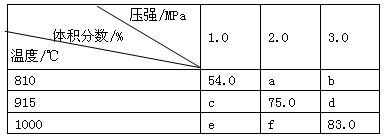
①b<f ②915℃、2.0MPa时E的转化率为60% ③该反应的△S>0 ④K(1000℃)>K(810℃),上述①~④中正确的有
| A.4个 | B.3个 | C.2个 | D.1个 |
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是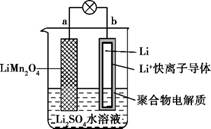
| A.a为电池的正极 |
B.电池充电反应为LiMn2O4 Li1-xMn2O4+xLi Li1-xMn2O4+xLi |
| C.放电时,a极锂的化合价发生变化 |
| D.放电时,溶液中Li+从b向a迁移 |