设NA为阿伏加德罗常数,下列说法正确的是( )
| A.将含1mol FeCl3的饱和氯化铁溶液逐滴加入沸水制备得到红褐色氢氧化铁胶体,其中含NA个Fe(OH)3胶体粒子。 |
| B.相同物质的量浓度的氨水和盐酸相比,氨水的导电能力强 |
| C.154g CCl4在标准状况下的体积是22.4L |
| D.H2SO4是电解质,但是H2SO4不能导电。 |
某一反应物的浓度是2.0 mol/L,经过4 min后,它的浓度变成了1.68 mol/L,则在这4 min内它的平均反应速率为()。
| A.0.2 mol·L-1·min-1 | B.0.1 mol·L-1·min-1 |
| C.0.04 mol·L-1·min-1 | D.0.08 mol·L-1·min-1 |
10 mL 1mol/L的盐酸与一小块大理石的化学反应CaCO3+2HCl=CaCl2+CO2↑+H2O,下列措施能使化学反应速率提高的是()。
| A.加入一定量的CaCl2 | B.加入5 mL 1.5 mol/L的盐酸 |
| C.加入15 mL 0.5 mol/L的盐酸 | D.加入5 mL H2O |
下列说法不正确的是()。
| A.温度升高,正逆反应速率都增大。 |
| B.化学反应的速率和限度均可通过改变化学反应条件而改变。 |
| C.可逆反应只是代表少数反应。 |
| D.化学反应达到平衡状态时,正反应速率与逆反应速率相等。 |
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是 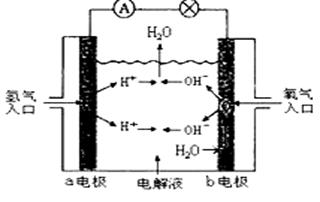
| A.a电极是负极 |
| B.b电极的电极反应为:4OH--4e-="=" 2H2O+O2↑ |
| C.氢氧燃料电池是一种具有应用前景的绿色电源 |
| D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置。 |
下列变化的比较, 不正确的是
| A.酸性强弱: HClO4> H2SO4> H3PO4> H4SiO4 |
| B.原子半径大小: Na > S > O |
| C.碱性强弱: KOH > NaOH > LiOH |
| D.还原性强弱: F-> Cl-> I- |