在强酸性无色透明溶液中,下列各组离子不能大量共存的是( )
| A.Fe3+、K+、Cl-、MnO4- | B.K+、Na+、NO3-、Cl- |
| C.Zn2+、Al3+、SO42-、Cl- | D.Ba2+、NH4+、Cl-、HCO3- |
BaSO4在医学上用作钡餐的理由,其中正确的是()
①既不溶于水又不溶于酸②对人体无害③不易被X射线透过④有治疗疾病的作用
| A.只有① | B.①和③ | C.①和④ | D.②和③ |
鉴别纯碱、石灰石、芒硝、石膏四种固体物质,下列试剂中应该选用()
| A.NaOH溶液 | B.水、盐酸 | C.硝酸溶液 | D.BaCl2和HNO3的混合液 |
用下列一种试剂可以同时鉴别K2SO4、K2S、KOH、Ba(OH)2四种无色溶液的是( )
| A.AgNO3溶液 | B.CuSO4溶液 |
| C.稀H2SO4 | D.BaCl2溶液 |
在工业生产中,H2SO4的下列用途不正确的是( )
| A.制取漂白粉 | B.制取肥田粉 |
| C.制取氢氟酸 | D.制造农药和炸药 |
下列反应中,硫酸不作氧化剂的是( )
A.2HBr+H2SO4(浓)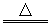 Br2+SO2↑+2H2O Br2+SO2↑+2H2O |
B.Ca3(PO4)2+2H2SO4(浓) 2CaSO4+Ca(H2PO4)2 2CaSO4+Ca(H2PO4)2 |
| C.2Al+3H2SO4====Al2(SO4)3+3H2↑ |
| D.2KMnO4+5H2S+3H2SO4====K2SO4+2MnSO4+5S↓+8H2O |