已知甲烷燃烧生成二氧化碳和液态水放出的热量为55.625 kJ·g-1。下列热化学方程式中不正确的是( )
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H =-890kJ/mol |
B.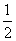 CH4(g)+O2(g)= CH4(g)+O2(g)=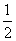 CO2(g)+H2O(l) △H=-445kJ/mol CO2(g)+H2O(l) △H=-445kJ/mol |
C.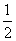 CO2(g)+H2O(l)= CO2(g)+H2O(l)=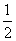 CH4(g)+O2(g) △H= +445kJ/mol CH4(g)+O2(g) △H= +445kJ/mol |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H =-55.625kJ/mol |
HPE是合成除草剂的重要中间体,其结构简式如下图所示。下列有关HPE的说法正确的是()
| A.HPE不能跟浓溴水反应 |
| B.HPE分子中有2个手性碳原子 |
| C.HPE在核磁共振氢谱中有6个峰 |
| D.1molHPE最多可以和2molNaOH反应 |
化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中,错误的是()
| A.钢铁腐蚀时可能发生的正极反应:2H2O + O2 + 4e—= 4OH— |
| B.表示H2燃烧热的热化学方程式:2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol |
C.纯碱水解的离子方程式:CO32— + H2O HCO3— + OH— HCO3— + OH— |
| D.Ca(HCO3)2溶液中加入过量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O |
下列实验能达到预期目的的是










 ()
()
 ①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸











 ;
;
②用饱和NaCl溶液除去Cl2中的少量HCl ;
;
③用饱和NaHCO3溶液除去CO2中的少量SO2;
④用加热的方法提取NH4Cl固体中混有的少量碘;

⑤用醋和澄清石灰水验证蛋壳中含有碳酸盐;
⑥用米汤检验食用加碘盐中含碘;
 ⑦用纯碱溶液洗涤餐具;
⑦用纯碱溶液洗涤餐具;
⑧用玻璃棒搅拌漏斗中的液体以加快过滤的速度; ⑨加入盐酸以除去硫酸钠中的少量碳酸钠杂质
⑨加入盐酸以除去硫酸钠中的少量碳酸钠杂质
| A.①④⑤⑨ | B.②③⑤⑦ | C.②③⑤⑧ | D.②③⑤⑥⑦ |
下列各组离子能在指定溶液中能大量共存的是()
①无色溶液中:Cl-,Na+,H2PO4—,PO43—,SO42—
②含有HCO的溶液中:SO42—,Na+,NO3—,MnO4—,CO32—
③水电离的H+浓度为1×10-13mol·L-1的溶液中:Cl—,HCO3—,NO3—,NH4+,S2O32—
④加入Fe能放出H2的溶液中:Mg2+,NH,C1-,K+,SO42—
⑤使甲基橙变红的溶液中:Fe3+,MnO4—,NO3—,Na+,SO42—
⑥在AlCl3溶液中:Fe3+,NO3—、I-,Cl-,SO42—
| A.②③⑤ | B.①③⑥ | C.②④⑤ | D.①②④ |
在某稀硝酸的溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+物质的量之比为()
| A.1:1 | B.3:2 | C.2:1 | D.4:1 |