碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
向一种一元强酸HA溶液中加入一种碱MOH,溶液呈中性,下列判断正确的是
| A.加入的碱过量 |
| B.反应后溶液中c(A-)=c(M+) |
| C.混合前酸与碱中溶质的物质的量相等 |
| D.生成的盐发生水解 |
下列有关实验操作的说法错误的是
| A.中和滴定时盛待测液的锥形瓶中有少量水对滴定结果无影响 |
| B.在酸碱中和滴定实验中,滴定管都需润洗,否则引起误差 |
| C.滴定时,右手控制滴定管活塞,左手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D.称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘 |
下列有关实验的做法正确的是
| A.用pH试纸测氯水的pH |
| B.用托盘天平称取5.72 g NaCl晶体 |
| C.用酸式滴定管量取20.00 mL的酸性KMnO4溶液 |
| D.用带磨口玻璃塞的试剂瓶保存Na2CO3溶液 |
在由水电离出的c(OH-)=1×10-13 mol·L-1的溶液中,能大量共存的离子组是
A.Fe2+ Na+ NO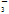 Cl- Cl- |
B.Ba2+ Na+ NO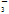 Cl- Cl- |
C.SO SO SO NH NH Na+ Na+ |
D.Mg2+ Na+ Br- ClO- |
常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是
①b不可能显碱性 ②a可能显酸性或碱性 ③a不可能显酸性 ④b可能显碱性或酸性
| A.③④ | B.①③ | C.②④ | D.①② |