已知下列两个热化学方程式:2CO(g) + O2(g) = 2CO2(g)△H =- 586.7 kJ/mol
2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ/mol,实验测得:CO与H2的混合气体5.8g,完全燃烧时,放出的热量为87.25KJ,则混合气体中CO和H2的体积比为 ( )
| A.1 :1 | B.2 :1 | C.2 :3 | D.1 :3 |
现有反应X(g)+Y(g) 2Z(g)△H<0。下图表示从反应开始到t
2Z(g)△H<0。下图表示从反应开始到t s时达到平衡,在t
s时达到平衡,在t s时由于条件变化使平衡破坏,到t
s时由于条件变化使平衡破坏,到t s时又达平衡。则在图中t
s时又达平衡。则在图中t s时改变的条件可能是
s时改变的条件可能是
| A.增大压强 |
| B.使用了催化剂 |
| C.降低温度 |
| D.减小了X或Y的浓度 |
KHSO 、BaCl
、BaCl 、Na2CO
、Na2CO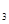 、FeSO
、FeSO 和氯水五种溶液,如图所示的相互反应,图中每条连线两端的物质可以发生化学反应。下列说法不合理的是
和氯水五种溶液,如图所示的相互反应,图中每条连线两端的物质可以发生化学反应。下列说法不合理的是
A.X一定为KHSO |
B.Y一定为Na CO CO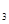 |
| C.Z可能是氯水 |
D.M、N必定各为BaCl 、FeSO 、FeSO 中的一种 中的一种 |
已知2SO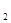 (g)+O
(g)+O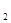 (g)
(g) 2SO
2SO (g)△H=-197 kJ·mol
(g)△H=-197 kJ·mol 。向同温、同体积的三个密闭容器中分别通入气体:(甲)2mol SO
。向同温、同体积的三个密闭容器中分别通入气体:(甲)2mol SO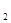 和1mol O
和1mol O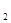 ;(乙)1mol SO
;(乙)1mol SO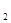 和0.5mol O
和0.5mol O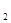 ;(丙)2mol SO3。恒温恒容下反应达到平衡时,下列关系一定正确的是
;(丙)2mol SO3。恒温恒容下反应达到平衡时,下列关系一定正确的是
A.容器内压强p:p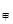 =p =p >2p >2p |
B.SO 的质量m:m 的质量m:m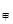 =m =m >2m >2m |
C.c(SO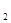 )与c(O )与c(O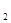 )之比k:k )之比k:k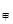 =k =k >k >k |
D.反应放出或吸收的热量的数值Q:Q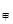 =Q =Q >2Q >2Q |
下图为电解饱和食盐水的简易装置,下列有关说法正确的是
| A.电解一段时间后,往蛋壳中溶液中滴加几滴酚酞,呈红色 |
| B.蛋壳表面缠绕的铁丝发生氧化反应 |
| C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝 |
| D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触 |
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni O
O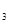 +3H
+3H O=Fe(OH)
O=Fe(OH) +2Ni(OH)
+2Ni(OH) 下列有关该电池的说法不正确的是
下列有关该电池的说法不正确的是
A.电池的电解液为碱性溶液,正极为Ni O O 、负极为Fe 、负极为Fe |
B.电池放电时,负极反应为Fe+2OH -2e -2e =Fe(OH) =Fe(OH) |
| C.电池充电过程中,阴极附近溶液的pH降低 |
D.电池充电时,阳极反应为2Ni(OH) +2OH +2OH -2e -2e =Ni =Ni O O +3H +3H O O |