用下图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升.下列说法正确的是
( )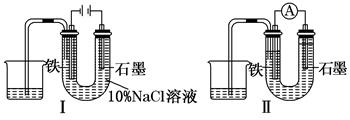
| A.同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多 |
| B.用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-=== Fe(OH)2 |
| C.用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-=== H2↑ |
| D.装置Ⅰ通电10分钟后铁电极周围溶液pH降低 |
用向上排气法收集氯气时,判断瓶中氯气是否充满可选用
| A.沾有酚酞的试纸 | B.湿润的碘化钾淀粉试纸 |
| C.沾有氢氧化钠浓溶液的试纸 | D.观察瓶内气体颜色的变化 |
在一定温度下,向饱和苛性钠溶液中放一定量的过氧化钠,充分反应后恢复到原温度,下列有关说法中,正确的是
| A.溶液中Na+浓度增大,有O2放出 | B.溶液的碱性不变,有H2放出 |
| C.溶液中Na+数目减少,有O2放出 | D.溶液的碱性不变,有O2放出 |
某无色溶液能与铝作用生成氢气,则溶液中可能大量共存的离子组是:
| A.H+、Ba2+、Mg2+、Cl- | B.Cl-、CO32-、Cu2+、Mg2+ |
| C.NO3-、SO42-、K+、H+ | D.NO3-、OH-、Ba2+、Cl- |
下图是向MgCl2、AlCl3混合溶液中,开始滴加7ml试剂A,之后改滴试剂B,所得沉淀ymol 与试剂体积V(ml)间的关系.以下结论不正确的是

A.横坐标从5到6溶液中Al3+浓度在上升 |
B.原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl—)=1∶1∶5 |
C.A是NaOH,B是盐酸,且c(NaOH)∶c(HCl)=2∶1 |
| D.横坐标从6到9,相应离子反应式H++OH— =H2O |
根据下列反应判断有关物质还原性由强到弱的顺序是
H2SO3 + I2 + H2O ="==" 2HI + H2SO4 2FeCl3 + 2HI ="==" 2FeCl2 + 2HCl + I2
3FeCl2 + 4HNO3 ="==" 2FeCl3 + NO↑+ 2H2O + Fe(NO3)3
| A.H2SO3> HI > FeCl2> NO | B.HI > FeCl2> H2SO3> NO |
| C.FeCl2>HI > H2SO3> NO | D.NO >FeCl2> H2SO3> HI |