下列反应中水既不是氧化剂又不是还原剂的氧化还原反应是( )
| A.SO3+ H2O = H2SO4 |
| B.2Na2O2 +2H2O = 4NaOH + O2↑ |
| C.2F2+2H2O = 4HF+O2 |
| D.2Na+2H2O = 2NaOH + H2↑ |
下列离子方程式正确的是
| A.电解氯化镁溶液:2Cl¯+ 2H2O ═ 2OH¯ + H2↑+ Cl2↑ |
| B.将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-═SO32-+2HClO |
| C.将少量CO2气体通入苯酚钠溶液中:2C6H5O- + CO2 + H2O→2C6H5OH +CO32- |
| D.硫酸亚铁酸性溶液中加入过氧化氢:2Fe2+ + H2O2 +2H+ = 2Fe3+ + 2H2O |
用NA代表阿伏加德罗常数,下列说法正确的是
| A.14g C2H4和C4H8的混合气体中所含的共价键数为3NA |
| B.标准状况下,11.2 L SO3所含的分子数为0.5 NA |
| C.24g 3H218O含有的中子数为12NA |
| D.0.1 mol O22-所含的电子数为1.6NA |
化学知识在生产和生活中有着重要的应用。下列说法中,错误的是
| A.家中发生天然气泄漏,不能在室内用电话报警 |
| B.洁厕剂和漂白精不能混合使用,否则易产生有毒气体 |
| C.双氧水可用于杀菌、消毒、漂白 |
| D.明矾既可用于净水,又可杀菌消毒 |
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
| A.H2(g)的燃烧热ΔH=-571.6 kJ·mol-1 |
| B.H2SO4(aq)+Ba(OH)2(aq)= BaSO4(s)+2H2O(l) ΔH=-57.3 kJ·mol-1 |
| C.同质量的H2(g)和CH3OH(l)完全燃烧生成液态水,H2(g)放出的热量多 |
| D.3H2(g)+CO2(g)= CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1 |
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示。已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的元素(不考虑稀有气体的原子半径);Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是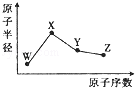
| A.简单离子半径:Z>X>W |
| B.最简单气态氢化物的稳定性:Y<Z |
| C.化合物XZW中既含离子键又含共价键 |
| D.Y的氧化物能与X的最高价氧化物对应的水化物反应 |