甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4 种溶液中的一种。将它们两两混合后,观察到的现象是:
①甲与乙或丙混合都产生沉淀;
②丙与乙或丁混合也产生沉淀;
③丁与乙混合产生无色气体。回答下面问题:
(1)写出丁与乙反应的离子方程式: 。
(2)这四种溶液分别是:甲: 、乙: 、丙: 、丁:
如图所示,当关闭K时,向A中充入4molX、14molY,向B中充入2molX、7molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g) Z(g)+2W(g) △H<0。达到平衡(Ⅰ)时,B中密度变为原来的
Z(g)+2W(g) △H<0。达到平衡(Ⅰ)时,B中密度变为原来的 ,试回答:
,试回答:
(1)设A、B两容器中化学平衡常数分别为K1和K2,则它们的大小关系是K1____K2(填“大于”或“等于”或“小于”)。
(2)B中X的转化率α(X)B为。
(3)A中Z和B中的W物质的量的比较:
n(Z)An(W)B(填“大于”或“等于”或“小于”)。
(4)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为升(用含a的代数式表示,连通管中气体体积不计);在温度不变的情况下,要使B容器恢复原来反应前的体积,可采取的措施是。
煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)===CO2(g) ΔH=E1①
b.C(s)+H2O(g)===CO(g)+H2(g) ΔH=E2②
H2(g)+O2(g)===H2O(g) ΔH=E3③
CO(g)+O2(g)===CO2( g) ΔH=E4④
g) ΔH=E4④
回答:
(1)上述 四个热化学方程式中的哪些反应ΔH<0?(填序号)
四个热化学方程式中的哪些反应ΔH<0?(填序号)
____________________________________________________________________。
(2)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是( )
A.a比b多 B.a比b少 C.a与b在理论上相同
B.a比b少 C.a与b在理论上相同
(3)根据能量守恒定律,E1、E2、E3、E4之间的关系为
__________________________________________________________________。
将BaCl2·xH2O的晶体2.44g溶于水,配成100mL溶液,取此溶液25mL,与50mL 0.1mol/L的AgNO3溶液相作用,刚好把Cl-离子沉淀完全。求:
(1)2.44g BaCl2·xH2O的物质的量为
(2)求Ba Cl2·xH2O的摩尔质量为
Cl2·xH2O的摩尔质量为
(3)求BaCl2·xH2O的x值为
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Fe3+、CO32—、SO42—,现每次取100ml进行实验。(已知NH4+与OH 在溶液中可发生下列反应 NH4+ + OH
在溶液中可发生下列反应 NH4+ + OH =NH3
=NH3 +H2O)
+H2O)
(1)第一份加入AgNO3溶液有沉淀产生。
(2)第二份加足量NaOH后加热,收集到气体0.896L(标准状态下)。
(3)第三份加足量BaCl2后,得干燥沉淀6.27g,沉淀经足量盐酸洗涤干燥后,剩2.33g。
试回答有关问题:
①判断K+、Cl-是否存在?K+Cl-(填下列序号)
A.一定存在 B.可能存在 C.一定不存在
②肯定存在的离子的原溶液中的物质的量浓度分别为
。
如图所示,在一烧杯中盛有H2SO4溶液, 同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H
同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H 2SO4和Ba(OH)2溶液密度相同]。试回答
2SO4和Ba(OH)2溶液密度相同]。试回答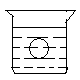
 ⑴此实验中,观察到的现象有
⑴此实验中,观察到的现象有
①,
②。
⑵写出实验过程中反应的离子方程式为。