根据下列反应: (1) 2Fe3+ +2I- = 2Fe2+ +I2 (2) Br2 + 2Fe2+ = 2Br-+2Fe3+,判断离子的还原性由强到弱的顺序是( )
| A.Br- > I-> Fe2+ | B.I- > Fe2+ > Br- | C.Fe2+ > I-> Br- | D.Br- > Fe2+ > I- |
反应A2+B2 2AB,在温度或压强改变时,AB%的变化如图所示。a为500℃、b为300℃时的情况;c为300℃时,从t3时刻开始向容器中加压的情况。则下列叙述正确的是:
2AB,在温度或压强改变时,AB%的变化如图所示。a为500℃、b为300℃时的情况;c为300℃时,从t3时刻开始向容器中加压的情况。则下列叙述正确的是: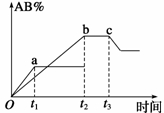
| A.A2、B2、AB均为气体,正反应放热 |
| B.AB为气体,A2、B2中最少有一种为非气体,正反应放热 |
| C.AB为气体,A2、B2中最少有一种为非气体,正反应吸热 |
| D.AB为液体,A2、B2中最少有一种为非气体,正反应吸热 |
下列过程都与热量变化有关,其中表述不正确的是:
| A.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为 CO (g)+ 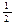 O2(g) O2(g) CO2 (g);△H=—283.0 kJ/mol CO2 (g);△H=—283.0 kJ/mol |
| B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钡溶液发生反应的热化学方程式为 1/2H2SO4(aq)+ 1/2Ba(OH)2(aq)=BaSO4(s)+H2O(l);△H=" —57.3" kJ/mol |
| C.铝热反应是放热反应,但需要足够的热量才能使反应发生 |
| D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小 |
关于下图所示各装置的叙述中,正确的是()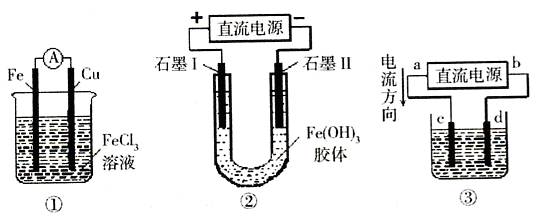
| A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| B.装置①中,铁做负极,电极反应式为:Fe3++e-=Fe2+ |
| C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
| D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
右图表示可逆反应A(固)+B(气) nC(气);△H=Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。
nC(气);△H=Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。
下列有关叙述中一定正确的是()
| A.其他条件相同,a表示使用了催化剂,b没有使用催化剂 |
| B.其他条件相同,若只改变温度,则a比b的温度高且△H>0 |
| C.其他条件相同,若只改变压强,则a比b的压强大且n≥2 |
| D.其他条件相同,若改变A的物质的量,则a比b用A的物质的量少 |
下列离子方程式正确的是()
| A.NaHCO3溶液和NaOH溶液混合HCO3-+OH- |
| B.将少量的二氧化硫气体通入氯化钙溶液中SO2+H2O+Ca2+ |
| C.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O |
| D.铜片与稀HNO3反应:3Cu+2NO3-+8H+ |