(4分)有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验: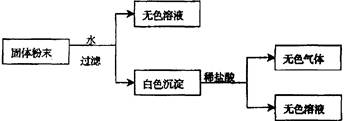
从实验可以判断,该固体粉末中
(1)一定不含有 。
(2)写出无色气体的分子式 。
已知溴原子与氯原子最外层电子数相同,Br2、Cl2在物质分类中都被划分为非金属中的一类元素。
(1)试根据Cl2的化学性质预测Br2的化学性质(用化学方程式表示,至少写3条):
①________________________________ ;
②________________________________ ;
③________________________________ 。
(2)预测Br2的化学性质,可采用的方法是________,欲验证以上预测的正误,可采用的方法是________________________________ 。
有X、Y、Z三种元素,已知①X、Y、Z的单质在常温下均为气体;②X单质可在Z单质中燃烧,生成XZ,火焰为苍白色;③XZ极易溶于水,电离出X+和Z-,其水溶液可使蓝色石蕊试纸变红;④每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体;⑤Z单质溶于X2Y中,所得溶液具有漂白作用。
(1)推断X、Y、Z三种元素的名称为:X.________,Y._______,Z._______。
(2)化合物的化学式:XZ_______,X2Y_______。
(3)五个过程中涉及的化学反应的方程式为________、________、________。
硅晶体结构类似于金刚石,低温下单质硅不活泼,与空气、H2O、酸均无作用,但可与强碱和强氧化剂在适当温度下作用,如硅能与卤素在加热或高温下生成四卤化硅;高价态硅的化合物可在高温下被碳、镁、氢等还原剂还原成单质硅;工业上也可用硅与焦炭在高温下制金刚砂(SiC)。某高纯硅炼制厂利用食盐、石英、水、焦炭为原料制取用作半导体材料的高纯硅。根据上述材料回答:
(1)假设根据每步反应建立一个生产车间,该高纯硅厂家需要几个车间
A.3个 B.4个 C.5个 D.6个
(2)生产原理中没有涉及到的反应是
A.置换反应 B.复分解反应
C.化合反应 D.电解反应
(3)该厂家不采用石英与焦炭直接制高纯硅的主要原因是
A.产量太低 B.产品中含SiC
C.产品中含有过量的硅石和焦炭 D.耗能太大
有三种透明、不溶于水的坚硬固体。A固体在氧气中完全燃烧只得到一种无色无味气体,此气体能使澄清石灰水变浑浊,标准状况下测得此气体的密度是氧气密度的1.375倍。B固体能溶于热的苛性钠溶液,再往该溶液中加入过量盐酸时,析出白色沉淀,此沉淀是一种比H2CO3还弱的酸,干燥后为不溶于水的白色粉末。B与石灰石、纯碱按一定比例混合加热后,能得到C,C在高温时软化,无固定熔点。根据以上事实,判断A、B、C各为何物,写出有关反应的化学方程式。
由“嫦娥奔月”到“万户飞天”,由“东方红”乐曲响彻寰宇到航天员杨利伟遨游太空,中华民族载人航天的梦想已变成现实。载人飞船上两副硅太阳能电池帆板提供了飞船所需的电力。请画出硅原子的原子结构示意图____________。