水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)、Pb(OH)  ,各形态的浓度分数α随溶液pH变化的关系如下图所示:
,各形态的浓度分数α随溶液pH变化的关系如下图所示:
(1)Pb(NO3)2溶液中,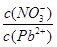 ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,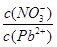 增加,可能的原因是________________________________。
增加,可能的原因是________________________________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有__________,pH=9时主要反应的离子方程式为_______________________。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
| 离 子 |
Pb2+ |
Ca2+ |
Fe3+ |
Mn2+ |
Cl- |
| 处理前浓度/(mg·L-1) |
0.100 |
29.8 |
0.120 |
0.087 |
51.9 |
| 处理后浓度/(mg·L-1) |
0.004 |
22.6 |
0.040 |
0.053 |
49.8 |
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是________。
(4)如果 该脱铅剂(用EH表示)脱铅过要发生的反应程中主为:2EH(s)+Pb2+ E2Pb(s)+2H+则脱铅的最合适pH范围为( )
E2Pb(s)+2H+则脱铅的最合适pH范围为( )
A.4~5 B.6~7 C.9~10 D.11~12


 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:

 (1)A与银氨溶液反应有银镜生成,则A的结构简式是。
(1)A与银氨溶液反应有银镜生成,则A的结构简式是。 (2)B→C的反应类型是。
(2)B→C的反应类型是。 (3)E的结构简式是。
(3)E的结构简式是。 (4)写出F和过量NaOH溶液共热时反应的化学方程式
(4)写出F和过量NaOH溶液共热时反应的化学方程式 。
。 (5)下列关于G的说法正确的是。
(5)下列关于G的说法正确的是。
a.能与溴单质反应b.能与金属钠反应 c.1molG最多能和3mol氢气反应 d.分子式是C9H6O3
c.1molG最多能和3mol氢气反应 d.分子式是C9H6O3
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等,请回答下列问题:
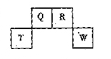
 (1)T的原子结构示意图为。
(1)T的原子结构示意图为。 (2)元素的非金属性为(原子的得电子能力):Q ______ W(填“强于”或“弱于”)。
(2)元素的非金属性为(原子的得电子能力):Q ______ W(填“强于”或“弱于”)。 (3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是。 (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是。 (6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的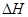 =(注:题中所涉单质均为最稳定单质)。
=(注:题中所涉单质均为最稳定单质)。
取来两份等浓度的NaOH溶液A和B,每份10ml,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,
试回答下列问题:
(1)原NaOH溶液的物质的量浓度为 _______________mol/L
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质为(写化学式)___________________;其物质的量之比为_____________。
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸产生CO2气体体积(标准状况)的最大值为________________ml。
(共10分)中学化学中几种常见物质的转化关系如下图所示:
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体F微粒直径大小的范围:__________。
(2)A、B、H的化学式:A________、B________、H________。
(3)①写出C的酸性溶液与双氧水反应的离子方程式:________________________。
②写出鉴定C中阳离子的实验方法和现象:_______________________。
③在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:_______________________________________________。
(共10分)
(1)除去NaHCO3溶液中混有的Na2CO3,相应的化学方程式_____________。
(2)除去Na2CO3固体中混有的NaHCO3,相应的化学方程式_____________。
(3)除去CO2气体中混有的HCl,相应的离子方程式___________________。
(4)除去Fe2O3中混有的Al2O3,相应的离子方程式_____________________。
(5)除去FeCl3溶液中混有的FeCl2,相应的离子方程式__________________。