下列实验设计和结论相符的是
| A.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 |
| B.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- |
| D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 |
下列的叙述中不正确的是( )
| A.卤化氢分子中,卤素的非金属性越强,共价键的极性越强,稳定性也越强 |
| B.以非极性键结合的分子,不一定是非极性分子 |
| C.判断A2B或AB2型分子是否是极性分子的依据是,具有极性键且分子构型不对称、键角小于180°的非直线型结构 |
| D.非极性分子中,各原子间都应以以非极性键结合 |
用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
| A.V形;平面三角形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.直线形;三角锥形 |
下列关于配合物的叙述中,不正确的是 ()
| A.配位化合物中必定存在配位键 |
| B.配位化合物中只有配位键 |
| C.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用 |
| D.[Cu(H2O)6]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤电子对形成配位键 |
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为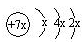 ,b与c形成化合物的电子式
,b与c形成化合物的电子式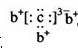 为下列比较中正确的是()
为下列比较中正确的是()
| A.原子半径:a>c>d>b | B.电负性:a>b>d>c |
| C.最高价含氧酸的酸性:c>d>a | D.第一电离能:d>a>b>c |
在周期表主族元素中,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断中,正确的是()
原子半径;丙>乙>甲>丁
气态氢经物的稳定性:甲>丙
最高价氧化物对应水化物的酸性:丁>甲
乙和甲或乙和丁所能形成的化合物都是有毒物质