下列叙述正确的是( )
| A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a=b+1 |
| B.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的c (NH4+) = c(Cl-) |
| C.25℃0.5×10-3 mol/L硫酸的pH=3.0,升高温度溶液pH增大 |
| D.100℃时,KW= 10-12,若pH=1的盐酸与pH=11NaOH溶液混合后,溶液的pH=7,则盐酸与NaOH溶液体积比为1:1 |
硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。下列对于反应 2SO2+O2
2SO2+O2 2SO3的说法中正确的是:
2SO3的说法中正确的是:
| A.只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B.该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零 |
| C.在达到平衡的体系中,充入由18O原子组成的O2后,SO2中18O含量减少,SO3中18O含量增多 |
| D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
下列叙述中,甲金属一定比乙金属活泼性强的是:
| A.甲原子电子层数比乙原子的电子层数多 |
| B.在甲乙两种金属和盐酸构成的原电池中,甲作正极,乙作负极 |
| C.1mol 甲和乙分别与足量的盐酸反应,产生H2的量:甲>乙 |
| D.常温时,甲能从水中置换出氢,而乙不能 |
下列条件下的反应,放出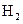 最快的是:
最快的是:
| 金属(粉末状)/mol |
酸的浓度和体积(mL) |
反应温度 |
|||
| A |
Mg |
0.1 |
3mol/LH2SO4 |
10 |
20℃ |
| B |
Al |
0.1 |
3mol/LHCl |
10 |
20℃ |
| C |
Zn |
0.1 |
3mol/LCH3COOH |
10 |
20℃ |
| D |
Fe |
0.1 |
6mol/LHNO3 |
10 |
20℃ |
下列关于可逆反应的叙述正确的是( )
| A.可逆反应是指既能向正反应方向进行,同时又能向逆反应方向进行的反应 |
B.2H2O 2H2+O2与2H2+O2 2H2+O2与2H2+O2 2H2O互为可逆反应 2H2O互为可逆反应 |
| C.对于可逆反应,当正反应速率增大时,逆反应速率就会减小 |
| D.外界条件对可逆反应的正、逆反应速率影响的程度不一定相同 |
下列叙述正确的是:
| A.固体碘转化为紫红色气体,需吸收能量,因共价键被破坏 |
| B.碳酸氢铵是典型离子化合物,其受热分解产生氨气不仅破坏离子键还破坏了共价键 |
| C.金属和非金属所形成的化学键均为离子键 |
| D.共价键只存在于共价化合物中 |