2SO2(g)+O2(g)  2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
| A.催化剂V2O5不改变该反应的逆反应速率 |
| B.恒压,通入稀有气体,反应速率不变 |
| C.该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO2(g)消耗的平均速率为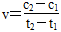 |
将充有amLNO和bmLNO2的试管倒立于水槽中,然后再通入amLO2,若a<b,则充分反应后,试管内剩余气体的体积是
A.(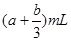 |
B.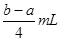 |
C.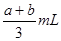 |
D.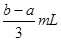 |
下图中A、B、C、D四条曲线分别表示IVA、VA、VIA、VIIA族元素的气态氢化物的沸点,其中表示VIA族元素气态氢化物沸点的是曲线 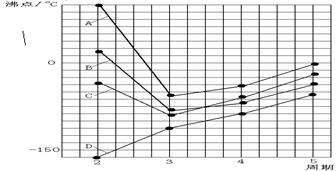
A.A B.B C.C D.D
下列物质既能跟浓H2SO4反应,又能与烧碱反应的是
①MgCl2②NaHCO3③(NH4)2 S ④Al(OH)3
| A.只有④ | B.除①外 | C.除①③ | D.全部都可以 |
四支试管分别充满O2、NO2、C12、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如下图所示,其中充满C12的试管是 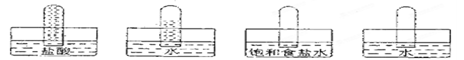
A B CD
能正确表示下列反应的离子方程式是
| A.向Fe(NO3)2稀溶液中加入盐酸: 3Fe2++4H++NO3-===3Fe3++NO↑+2H2O |
| B.铜片与浓HNO3: Cu+NO3-+4H+===Cu2++NO↑+2H2O |
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热: NH4++OH- NH3↑+H2O NH3↑+H2O |
| D.AlCl3溶液中滴加足量氨水: Al3++4NH3·H2O===AlO2-+4NH4++2H2O |