下列物质的制备,符合工业生产实际的是
| A.将氯气通入澄清石灰水中制漂白粉 |
| B.用离子交换膜法电解饱和食盐水制备烧碱、氢气和氯气 |
| C.将氢气和氯气混合后点燃,产物用水吸收制备盐酸 |
| D.工业制硫酸在吸收塔中用水吸收SO3生成硫酸 |
下列各组中化合物的性质比较,不正确的是()
| A.酸性:HClO4>HBrO4>HIO4 | B.碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C.稳定性:PH3<H2S< HCl | D.熔沸点:H2O<H2S<H2Se<H2Te |
下列判断正确的是
①放热反应在常温下一定很容易发生,吸热反应只有在一定条件下才可发生②反应热效应的产生是由于反应前后反应物和生成物的总键能不同造成的。③任何反应中的能量变化都表现为热量变化④反应的热效应就是焓变⑤由于吸热反应后体系的能量升高,因此规定吸热反应的焓变为“+ ”
| A.②③④ | B.①③⑤ | C.①②④⑤ | D.②⑤ |
有人建议将氢元素排在元素周期表的ⅦA族。下列事实能支持这一观点的是()
①H原子得到一个电子实现最外电子层稳定结构;②氢分子的结构式为H—H;③与碱金属元素形成离子化合物M+[∶H]-;④分子中原子间的化学键都属于非极性键
| A.只有①②③ | B.只有①③④ | C.只有②③④ | D.有①②③④ |
下列有关物质性质、结构的表述均正确,且存在因果关系的是
| 表述Ⅰ |
表述Ⅱ |
|
| A |
在水中,NaCl的溶解度比I2的溶解度大 |
NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
| B |
通常条件下,CH4分子比SnH4分子稳定性大 |
Sn的原子半径比C的大,Sn与H之间的键能比C与H间的键能小 |
| C |
在形成化合物时,同一主族元素的化合价相同 |
同一主族元素原子的最外层电子数相同 |
| D |
P4O10、C6H12O6溶于水后均不导电 |
P4O10、C6H12O6均属于共价化合物 |
实验是化学研究的基础,关于下列各装置图的叙述中,正确的是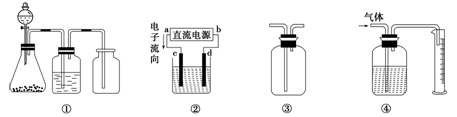
| A.装置①是一套实验室制气装置,用于发生、干燥和收集气体,如铜屑与稀硝酸反应制取气体 |
| B.装置②中,a为正极,d为阳极 |
| C.装置③可用于收集H2、NH3、Cl2、HCl、NO2等 |
| D.装置④能用于测量气体体积 |