下表列出了25℃时有关弱酸的电离平衡常数:
| 弱酸 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×10-5 |
4.9×l0-10 |
K1=4.3×10-7 K2=5.6×10-11 |
则有关说法正确的是( )
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.95℃纯水的pH<7,说明加热可导致水呈酸性
C.pH=3的醋酸溶液,稀释至10倍后pH=4
D.0.02mol/L的盐酸,与等体积水混合后pH=2
下列关于甲、乙、丙、丁四种有机物的说法正确的是
| A.分别加入AgNO3溶液,均有沉淀生成 |
| B.加入NaOH的醇溶液共热,然后加入稀硝酸调至酸性,再滴入AgNO3溶液,均有沉淀生成 |
| C.加入NaOH的水溶液共热,后加入稀硝酸至酸性,再滴入AgNO3溶液,均有沉淀生成 |
| D.乙发生消去反应得到两种烯烃 |
咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为:
下列有关咖啡酸的说法中,正确的是
| A.咖啡酸分子中的所有碳原子不可能共平面 |
| B.1 mol咖啡酸与饱和溴水反应,最多消耗2.5 mol Br2 |
| C.1 mol咖啡酸与足量Na反应,最多产生3 mol H2 |
| D.咖啡酸可以发生加成、酯化、加聚等反应 |
已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡: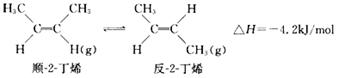
下列说法正确的是
| A.顺-2-丁烯比反-2-丁烯稳定 |
| B.顺-2-丁烯的燃烧热数值比反-2-丁烯大 |
| C.加压和降温都有利于平衡向生成顺-2-丁烯反应方向移动 |
| D.反-2-丁烯不能使溴水褪色 |
有一多肽其化学式为C55H70O19N10,将其彻底水解后只得到下列四种氨基酸:甘氨酸(H2N—CH2COOH),丙氨酸(CH3—CH(NH2)—COOH),苯丙氨酸( )谷氨酸(HOOC—(CH2)2—CH(NH2)—COOH),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是
)谷氨酸(HOOC—(CH2)2—CH(NH2)—COOH),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是
| A.10,4,3 | B.10,3,4 | C.9,4,3 | D.9,3,4 |
美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁·沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖。经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的
| A.该有机物属于芳香烃 |
| B.该有机物能发生水解反应,且1mol该有机物需消耗氢氧化钠2mol |
| C.该有机物能与溴水发生取代反应消耗Br23mol |
| D.该有机物既能与盐酸反应,又能与碳酸氢钠溶液反应 |