将0.15mol MnO2和50ml 12mol·L-1浓盐酸混合后缓慢加热,充分反应可制得氯气的物质的量为( )
| A.等于0.15mol | B.大于0.15mol | C.小于0.15mol | D.以上结论都不对 |
甲醇低压羰基合成法(CH3OH+CO→CH3COOH)是当今世界醋酸生产的主要方法,国标优等品乙酸含量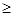 99.8%。为检验得到的乙酸中是否含有甲醇,可用的方法是
99.8%。为检验得到的乙酸中是否含有甲醇,可用的方法是
| A.观察放入金属Na是否产生气泡 |
| B.观察滴入的紫色石蕊溶液是否变红 |
| C.观察滴入的酸性KMnO4溶液是否褪色 |
| D.观察插入的表面发黑的灼热铜丝是否变红 |
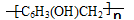 是制作电木的原料。下列围绕此物质的讨论正确的是
是制作电木的原料。下列围绕此物质的讨论正确的是
| A.该有机物没有确定的熔点 | B.该有机物通过加聚反应得到 |
| C.该有机物通过苯酚和甲醇反应得到 | D.该有机物的单体是 -C6H3OHCH2- |
我们熟知的一些化合物的应用错误的是
| A.MgO冶炼金属镁 | B.NaCl用于制纯碱 |
| C.Cu(OH)2用于检验糖尿病 | D.FeCl3用于净水 |
美国《Science》杂志曾经报道:在40 GPa高压下,用激光器加热到1800K,人们成功制得了原子晶体干冰。有关原子晶体干冰的推断错误的是
| A.有很高的熔点和沸点 | B.易汽化,可用作制冷材料 |
| C.含有极性共价键 | D.硬度大,可用作耐磨材料 |
可确定乙二醇分子是否有极性的实验是
| A.测定沸点 | B.测静电对液流影响 |
| C.测定蒸气密度 | D.测标准状况下气体摩尔体积 |