对下列实验过程的评价,正确的是( )
| A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
| B.某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- |
| C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 |
| D.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- |
下列有关物质分类或归类正确的是
| A.酸性氧化物:SO2、NO2、CO2、SiO2 |
| B.非电解质:液氨、氨水、液态氯化氢、过氧化氢 |
| C.电解质:氯化铝、胆矾、无水酒精、硫酸钡 |
| D.离子化合物:CH3COONa、Al2O3、Na2O2、CaC2 |
硝酸与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH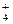 中的一种或几种。现有一定量的Al粉和Fe粉的混合物与100mL稀硝酸充分反应,反应过程中无任何气体放出。在反应结束后的溶液中逐滴加入4mol/L的NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图,则下列说法中不正确的是
中的一种或几种。现有一定量的Al粉和Fe粉的混合物与100mL稀硝酸充分反应,反应过程中无任何气体放出。在反应结束后的溶液中逐滴加入4mol/L的NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图,则下列说法中不正确的是
| A.与HNO3反应后,Fe元素的化合价为+3 |
B.D→E段反应的离子方程式为:NH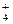 +OH-=NH3·H2O +OH-=NH3·H2O |
| C.纵坐标A点数值为0.008 |
| D.纵坐标B点数值为0.012 |
将a molNa和a molAl一同投入m g足量水中,所得溶液密度为d g·cm-3,该溶液的质量分数为
| A.82a/(46a+m)% | B.82000a/(46a+2m)% |
| C.8200a/(46a+m)% | D.8200a/(69a+2m)% |
往CuO和铁粉的混合物中,加入一定量的稀H2SO4并微热,当反应停止后,滤出不溶物,并向溶液 中插入一枚铁钉,片刻后,取出铁钉,发现铁钉并无变化,下面结论正确的是
中插入一枚铁钉,片刻后,取出铁钉,发现铁钉并无变化,下面结论正确的是
| A.不溶物一定是铜 | B.不溶物一定是铁  |
C.不溶物 中一定含铜,但不一定含铁 中一定含铜,但不一定含铁 |
D.溶液中一定含有FeSO4,可能含有CuSO4 |
科学家用NaNO3和Na2O在一定条件下化合制得由钠离子和阴离子B构成的晶体NaxNO4,测得阴离子B中各原子的最外层电子都达到了8电子稳定结构。下列说法错误的是
| A.x=3 | B.N的化合价为+3 |
| C.阴离子B的电子式可能为 | D.此反应是非氧化还原反应 |