迷迭香酸(F)的结构简式为: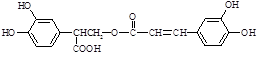 ;它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A、E等为原料合成F的路线如下:
;它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A、E等为原料合成F的路线如下: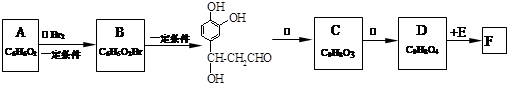
根据题意回答下列问题:
⑴写出结构简式:B____________________;C_____________________。
⑵写出反应类型:反应①________;反应②_____________。
⑶反应③所需的无机试剂:_____________________________。
⑷1 mol F分别与足量的溴水和NaOH溶液反应,最多可消耗Br2_____mol,NaOH____mol。
⑸D在一定条件下发生加聚反应的化学方程式是______________________________ 。
⑹与E互为同分异构体,且同时满足下列条件的有机物有_____________种。
①苯环上有四个取代基,且苯环上的一氯取代物只有一种。
②1 mol该物质分别与NaHCO3、Na2CO3反应时,最多消耗NaHCO3、Na2CO3的量分别是1 mol和4 mol。
(1)向澄清的石灰水不断通入二氧化碳直至过量时,溶液先变浑浊,后变澄清,有关离子方程式为____________________________、_______________________________
(2)若在饱和Na2CO3溶液中不断通入二氧化碳,将有晶体析出,该晶体是________,反应的化学方程式为____________________,析出晶体的原因是:
①______________;②______________;③______________。
在火焰上灼烧下列物质,火焰呈现黄色的有________(填编号)。
①碳酸钠 ②碳酸钾 ③硫酸钠 ④金属钠 ⑤氧化钠 ⑥过氧化钠 ⑦硫酸铜 ⑧氢氧化钡
钠放入到硫酸铜溶液中,现象是________,离子方程式为______。
在Fe、S2—、SO2、H+、Na+、S、Fe2+等物质或粒子中:
(1)只能被氧化,不能被还原的是;
(2)只能被还原,不能被氧化的是;
(3)既能被氧化,又能被还原的是。
在反应2F2+2H2O=4HF+O2中,作还原剂,元素被氧化;在反应Ca+2H2O=Ca(OH)2+H2↑中,作氧化剂,元素被还原。若在两个反应中,电子转移的物质的量相等时,产生氢气和氧气的质量比为。