某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g) Z(g)+W(s);ΔH>0则下列叙述正确的是
Z(g)+W(s);ΔH>0则下列叙述正确的是
| A.加入少量W,逆反应速率增大 | B.升高温度,平衡逆向移动 |
| C.当容器中气体压强不变时,反应达到平衡 | D.平衡后加入Z,上述反应的ΔH增大 |
下列陈述I、II正确并且有因果关系的是
| 选项 |
陈述I |
陈述II |
| A |
浓H2SO4有吸水性 |
浓H2SO4可用于干燥氨气 |
| B |
SO2有还原性 |
SO2尾气可用NaOH溶液吸收 |
| C |
Mg有还原性 |
电解MgCl2饱和溶液可制备Mg |
| D |
锌金属活动性比铁强 |
海轮外壳上装锌块可减缓腐蚀 |
短周期元素X原子核外的电子处于n个电子层上,最外层电子数为(2n+1),核内质子数为(2n2-1)。有关X的说法中不正确的是
| A.X元素气态氢化物的水溶液不可能呈酸性 |
| B.X能形成化学式为NaXO3的含氧酸钠盐 |
| C.X原子的最外层电子数和核电荷数不可能为偶数 |
| D.X元素常见单质的化学式为X2 |
下列叙述正确的是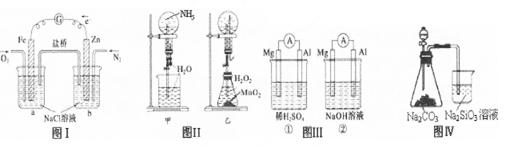
| A.图I装置中通入N2和O2的作用是相同的 |
| B.图Ⅱ中甲、乙两装置产生喷泉的原理一样 |
| C.图Ⅲ①装置中镁片是原电池的负极;②装置中镁片是原电池的正极 |
| D.图Ⅳ分液漏斗盛硝酸能证明非金属性N>C>Si,盛硫酸能证明非金属性S>C>Si |
下列离子方程式正确的是
| A.Cl2通入水中:Cl2+H2O=2H+ +Cl-+ClO- |
| B.硫酸镁溶液与氢氧化钡溶液混合:SO42- + Ba2+ =BaSO4↓ |
C.用铜作电极电解CuSO4溶液:2Cu2++2H2O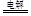 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| D.AlCl3溶液中加入过量氨水:Al3++3NH3•H2O =Al(OH)3↓+ 3NH4+ |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.室温下H2O2分解得到16 g O2,转移的电子数为2NA |
| B.含1mol H2SO4的浓硫酸与足量铜反应转移的电子总数为NA |
| C.标准状况下11.2 L CO和H2的混合气体完全燃烧消耗O2的量为0.25NA |
| D.相同物质的量OH-和CH3+含有相同数目的电子 |