【已知某燃料含碳、氢、氧三种元素,为了测定该燃料的组成:将该燃料放入足量氧气中燃烧,并使产生的CO2和H2O蒸气及剩余的O2全部通过如图所示的装置,得到如下表所列的实验数据(假设生成的气体全部被吸收)。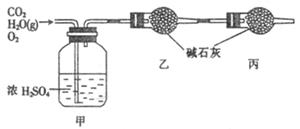
| |
实验前 |
实验后 |
| 甲的质量 / g |
101.1 |
103.8 |
| 乙的质量 / g |
82.0 |
86.4 |
根据实验数据填空:
(1)该燃料分子中碳、氢原子的数目比为 。
(2)已知该燃料分子的式量为46,且每个分子中含有1个氧原子,则其分子式为 。
将28.12 g还原铁粉(含少量FexC)在氧气流中加热,得到标准状况下的CO2 224mL;将相同质量的还原铁粉与足量硫酸反应,得标准状况下的H2 10.752L,计算FexC的化学式。
为测定某铜银合金的成分,将30.0g合金溶于80mL13.5mol/L的浓HNO3中,将合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的pH=0,假设反应后溶液的体积仍为80mL,试计算:
(1)被还原的HNO3的物质的量。
(2)合金中Ag的质量分数。
把20.95g干燥的氯酸钾与二氧化锰的混合物装入大试管中,加热到质量不变为止,剩余固体为16.15g,则:
(1)求生成的气体在标态下的体积
(2)剩余固体各成分的物质的量
(3)向剩余固体中加入过量的浓硫酸,全部氯元素成为两种含氯的混合气体,通入过量的碘化钾溶液,生成的碘被0.02mol Na2S2O3吸收,则生成的两种气体的体积(标态)是多少升?(已知:2Na2S2O3 +I2 →Na2S4O6+2NaI)
有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是
物质的量变化的曲线,请你在此图中再画出另外种离子的物质的量的变化曲线。
附加题:已知C6H12O6===2C2H5OH+2CO2(催化剂为酒化酶)现有500吨含淀粉70%的淀粉糊,淀粉水解率为80%,麦芽糖水解率为90%,葡萄糖分解率为85%,(淀粉水解为麦芽糖,麦芽糖水解为葡萄糖。麦芽糖与蔗糖互为同分异构体)问:
(1)写出以上水解的化学方程式;
(2)可制取含乙醇质量分数为9%的啤酒多少吨?