①在含有FeCl3和BaCl2的酸性混合液中,通入足量SO2气体,有白色沉淀生成,过滤后,向滤液中滴加KSCN溶液,不出现红色,在氨水和BaCl2的混合液中,通入适量SO2气体,也有白色沉淀生成,由此得出的结论是( )
| A.白色沉淀都是BaSO3 | B.①白色沉淀是BaSO3和S,②是BaSO3 |
| C.①白色沉淀是BaSO4,②是BaSO3 | D.①白色沉淀是FeSO3,②是BaSO3 |
据《华盛顿邮报》报道,美国食品与药物管理局2009年10月公布了一份草拟的评估报告,指出塑料奶瓶和婴儿奶粉罐中普遍存在的化学物质双酚A(如下图)并不会对婴儿或成人的健康构成威胁。关于双酚A的下列说法正确的是
| A.该化合物属于芳香烃 |
| B.该化合物与三氯化铁溶液反应显紫色 |
| C.双酚A不能使溴水褪色,但能使酸性高锰酸钾溶液褪色 |
| D.1mol双酚A最多可与2 mol H2发生加成反应 |
下列说法正确的是
| A.一定条件下可以用H2除去乙烷中混有的乙烯 |
| B.苯和四氯化碳都能萃取溴水中的溴 |
| C.乙醇、乙酸和乙酸乙酯三者的混合液可用分液的方法分离 |
| D.甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
1 L(标准状况下)某烃,完全燃烧生成的CO2和水蒸气在273 ℃、1.01×105 Pa下,混合气体体积为y L,当冷却至标准状况时气体体积为x L,下列用x、y表示该烃的化学式正确的是
A.CxHyB.CxHy-xC CxH2y-2xD.CxHy-2x
【改编】某有机物的分子式为C8H8,经研究表明该有机物不能发生加成反应和加聚反应,在常温下难被酸性KMnO4溶液氧化,但在一定条件下却可与Cl2发生取代反应,而且其一氯代物只有一种。下列对该有机物结构的推断中一定正确的是
| A.该有机物中含有碳碳双键或碳碳三键 |
| B.该有机物属于芳香烃 |
| C.该有机物分子可能是苯的同系物 |
| D.该有机物具有三维空间的立体结构 |
一种形状像布袋结构的烯烃分子Bowtiediene,其形状和结构如下图所示,有关该分子的说法不正确的是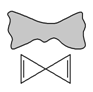
| A.该烯烃的分子式为C5H4 |
| B.该分子所有碳原子在同一平面 |
| C.1 mol该有机物最多可与2 mol Br2发生加成反应 |
| D.与其互为同分异构体且只含三键的链烃不止一种 |