Ⅰ.下列物质中:①氯化钠 ②干冰 ③盐酸 ④铜 ⑤硫酸钡 ⑥蔗糖
⑦I2 ⑧熔融的硝酸钾 ⑨食盐水
(1)能导电的是(填编号,下同) ;
(2)属于电解质的是 ;
(3)属于非电解质的是 。
Ⅱ.100mL 1 mol·L-1Al2(SO4)3溶液中含SO42-离子 个,含Al3+离子 mol。0.6mol O2与0.4mol O3质量之比为 ,分子个数之比为 ,原子个数之比 ,它们在同温同压下的体积比是 。
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源进行氯化镁溶液龟解实验,电解装置如图所示。
请回答下列问题:
(1)甲烷燃料电池负极的电极反应式为: 。
(2)闭合开关K后,a、b电极上均有气体产生,其中a电极上的气体可用检验,b电极上得到的气体是,电解氯化镁溶液的离子方程式为。
(3)若甲烷通入量为1.12 L(标准状况),且反应完全,则理论上通过电解池的电子的物质的量为,产生的氯气体积为L(标准状况)。
(4)已知常温常压下,0.25molCH4完全燃烧生成CO2和H2O时,放出222.5kJ热量,请写出CH4燃烧热的热化学方程式。
已知;①C(石墨)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ/mol
计算:C(石墨)与H2(g)反应生成1molCH4(g)的△H=。
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+□=□Fe(OH)3↓+□C1-+□
②检验滤液B中是否还含有铁元素的方法为:
(注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为(填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、(填操作名称)、洗涤。
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为(填代号)。
某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42ˉ、SiO32ˉ、NO3ˉ中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。
请回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有 :
(2)溶液X中,关于NO3ˉ的判断一定正确的是;
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为;
(4)转化⑥发生反应的现象为;
(5)转化④中产生H的离子方程式为;
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比
为;
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是。
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMnO4溶液,
⑥氯水和KSCN的混合溶液
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式_______________。
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在周期表中的位置是_______________。
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为________________,制得的气体可用如图所示装置收集,则气体应从_______(填“A”或“B”)通入。
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为___________,若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为_______________、____________、
_____________。
(5)取一定量的X晶体分解,若生成F 1 mol,则必同时生成_______物质_____mol。
已知常温下B、D、E、L为密度比空气大的气体,D、E为单质,其他为化合物。A是一种淡黄色固体,C微溶于水,F、G均能与L的水溶液反应放出B。据下边反应框图填空。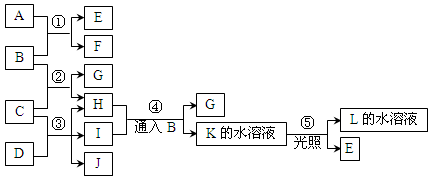
(1)F的俗名是,B分子的结构式为________工业上利用反应③生产。
(2)反应④的离子方程式为。
(3)有一种单质能与H反应生成E,该反应的化学方程式为。
(4)某气体M具有漂白作用,既有氧化性,又有还原性,M通入D的溶液中反应的离子方程式为。