PtCl4·2NH3水溶液不导电加入AgNO3无现象加强碱无NH3放出下列说法正确的是( )
| A.配合物中中心原子的电荷数和配位数均为6 |
| B.该配合物可能是平面正方形结构 |
| C.Cl-和NH3分子均与Pt4+配位 |
| D.配合物中Cl-与Pt4+配位,而NH3分子与Pt4+不配位 |
为了配制 的浓度与Cl-的浓度比为1∶1的溶液,可在NH4Cl溶液中加入()
的浓度与Cl-的浓度比为1∶1的溶液,可在NH4Cl溶液中加入()
①适量的HCl②适量的NaCl③适量的氨水④适量的NaOH
| A.①② | B.③ | C.③④ | D.④ |
在0.1 mol·L-1 Na2CO3溶液中,下列关系正确的是( )
A.c(Na+)=2c( ) ) |
B.c(OH-)=2c(H+) |
C.c( )>c(H2CO3) )>c(H2CO3) |
D.c(Na+)<c( )+c( )+c( ) ) |
为了使0.1 mol·L-1 Na2CO3溶液中c(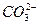 )接近0.1 mol·L-1,应采取( )
)接近0.1 mol·L-1,应采取( )
| A.加水 | B.通入CO2 |
| C.加入少量盐酸 | D.加入少量固体NaOH |
经测定,某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。其不可能的情形是( )
| A.该溶液由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成 |
| B.该溶液由0.2 mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合而成 |
| C.该溶液由0.1 mol·L-1的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合而成 |
| D.在上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
向少量Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,结果固体完全溶解。对此甲、乙两位同学各自作了自己的解释如下:
甲:Mg(OH)2(s) Mg2++2OH-①
Mg2++2OH-①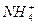 +H2O
+H2O NH3·H2O+H+②
NH3·H2O+H+②
H++OH-====H2O③
由于③的发生使平衡①右移,沉淀溶解。
乙:Mg(OH)2(s) Mg2++2OH-①
Mg2++2OH-①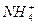 +OH-====NH3·H2O②
+OH-====NH3·H2O②
由于②的发生使平衡①右移,沉淀溶解。
丙同学用下面的一种试剂,重做了该实验,证明甲、乙的解释只有一种是正确的,他用的试剂是( )
| A.NH4NO3 | B.CH3COONH4 |
| C.(NH4)2SO4 | D.氨水 |