下列说法中错误的是( )
| A.SO2、SO3都是极性分子 |
| B.在H3O+和[Cu(H2O)4]2+中都存在配位键 |
| C.元素电负性越大的原子,该元素的原子吸引键合电子的能力越强 |
| D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
1986年,人们成功的用如下反应制得了氟:
①2KMnO4+2KF+10HF+3H2O2=2K2MnF6+8H2O+3O2
②K2MnF6+2SbF5=2KSbF6+MnF4 ③2MnF4=2MnF3+F2↑。下列说法中正确的是
| A.反应①、②、③都是氧化还原反应 | B.反应①H2O2既是还原剂又是氧化剂 |
| C.氧化性:KMnO4>O2 | D.每生成1mol F2,上述反应共转移2mol电子 |
下列有关铁及其化合物的说法中不正确的是
| A.工业上在高温下用CO还原含Fe2O3的铁矿石炼铁 |
| B.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 |
| C.工业上可用铁质容器储存、运输浓硝酸、浓硫酸 |
| D.氯化铁溶液有较强氧化性,故可用作净水剂 |
根据下列实验现象,所得结论正确的是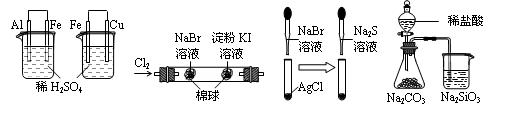
AB CD
| 实验 |
实验现象 |
结论 |
| A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
| B |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
| C |
白色固体先变为淡黄色,后变为黑色 |
溶解性:AgCl>AgBr>Ag2S |
| D |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
下列离子方程式中正确的是
| A.用氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ |
| B.用烧碱溶液吸收氯气:Cl2+2OH-=Cl-+ClO—+H2O |
| C.用氢氧化钡溶液中和硫酸氢铵溶液:H++SO42-+Ba2++OH-= H2O+BaSO4↓ |
| D.用饱和纯碱溶液溶解苯酚:CO32-+C6H5OH→HCO3-+C6H5O- |
镁燃料电池以镁合金作为电池的一极,另一极充入过氧化氢,电解质溶液是酸化的氯化钠溶液,放电时总反应:Mg+2H++H2O2= Mg2++2H2O。关于该电池说法正确的是
| A.镁合金为电源负极,发生氧化反应 | B.放电时H+在正极反应得电子 |
| C.正极方程式为:H2O2+2e-=2OH- | D.放电时正极的pH降低 |