决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: 。组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 。
| 共价键 |
C-C |
C-N |
C-S |
| 键能/ kJ·mol-1 |
347 |
305 |
259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如右图所示),已知3种离子晶体的晶格能数据如下表:
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是: 。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如右图所示,其分子内不含有 (填序号)。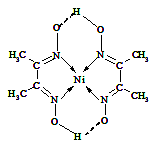
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键
某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:
已知:有关金属离子生成氢氧化物沉淀所需的pH如下表:
(1)滤渣1的主要成分为 。
(2)从滤液2中获得NiSO4.6H2O的实验操作 、 、过滤、洗涤、干燥。
(3)用离子方程式解释加入H2O2的作用 。
(4)加NiO调节溶液的pH至5,则生成沉淀的离子方程式有 。
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理如图:
①A电极反应式为 和2H++2e- =H2↑。
②若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),能得到Ni g。
(1)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸。
已知:①N2(g)+O2(g)=2NO(g)△H="+180.5" kJ/mol
②N2(g)+3H2(g)  2NH3(g)△H=-92.4 kJ/mol
2NH3(g)△H=-92.4 kJ/mol
③2H2(g)+O2(g) = 2H2O(g)△H=-483.6 kJ/mol
氨催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为 。
(2)研究在其他条件不变时,改变起始物氢气的物质的量对N2(g)+3H2(g)  2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):
①图像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)。
②a、b、c三点中,N2转化率最高的是 (填字母)。
③若容器容积为1L,T2℃在起始体系中加入1 mol N2,n(H2)=3mol,经过5 min反应达到平衡时H2的转化率为60%,则v(NH3)= 。保持容器体积不变,若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q___110.88 kJ(填“>”、“<”或“=”)。
按要求回答下列问题:
(1)有下列六种物质:①碳60(C60)晶体②硼晶体③Na2O晶体④ CaF2晶体⑤P4O10晶体⑥碳化硅晶体。其中属于离子晶体的是 ,属于分子晶体的是 ,属于原子晶体的是________________。
(2)有下列分子:HCN、P4、SO2、PCl3、BF3,其中属于非极性分子的是 。
(3)有下列离子:SO32-、SO42-、CO32-,其中空间构型为正四面体形的是 ,中心原子的杂化轨道类型属于sp2杂化的是 。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为___________;与每一个钙离子距离最近并且距离相等的钙离子有____________个 。
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是________________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g
(2)在完全放电耗尽PbO2和Pb时,若按图连接
则电解一段时间后,在A电极上生成________、B电极上生成________,此时铅蓄电池的正负极的极性将________
炼油厂常将裂解产生的其它烯烃加氢,对产物再次裂解以提高乙烯产量。相关加成反应如下:
① (g)+H2(g)
(g)+H2(g)  CH3CH2CH2CH3(g)△H1
CH3CH2CH2CH3(g)△H1
②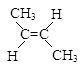 (g)+H2(g)
(g)+H2(g)  CH3CH2CH2CH3(g)△H2
CH3CH2CH2CH3(g)△H2
(1)已知反应①、反应②平衡常数K1、K2如下,下列叙述正确的是____;
| 温度(℃) |
300 |
320 |
340 |
| K1 |
4.8×10-4 |
2.5×10-4 |
1.3×10-4 |
| K2 |
8.4×105 |
3.5×103 |
1.6×103 |
A.△H1>0;△H2<0
B.反应①、反应②都是丙烯加氢,所以△H1=△H2
C.相同条件下反应②的转化率大于反应①的转化率
D.从平衡常数推测,相同条件下反应②的反应速率很大,反应①的反应速率很小
(2)2-丁烯的顺、反异构转换过程的△H=_______(用△H1、△H2表示) (g)
(g)
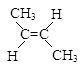 (g)△H
(g)△H
(3)在一定温度下,将等物质的量的反式2-丁烯和H2充入2L密闭容器中,发生反应②,容器内各物质浓度如图所示:
①前10分钟,平均反应速率v(H2)为______mol·L-1·min-1
②该温度下,此反应平衡常数K=_______(平衡常数不用写单位)
(4)已知表示H2和CH3CH2CH3标准燃烧热的热化学方程式为:
①H2(g)+ O2(g)
O2(g) H2O(l) △H=-285.8kJ•mol-1
H2O(l) △H=-285.8kJ•mol-1
②CH3CH2CH3(g)+5O2(g) 3CO2(g)+4H2O(l) △H=-2215kJ•mol-1
3CO2(g)+4H2O(l) △H=-2215kJ•mol-1
丁烯加成反应的热化学方程式为:
③CH3CH=CH2(g)+H2(g) CH3CH2CH3(g) △H=-125.4kJ•mol-1
CH3CH2CH3(g) △H=-125.4kJ•mol-1
则表示CH3CH=CH2标准燃烧热的热化学方程式为__________________。