) 金属材料在生产、生活中有着广泛的应用。
(1)下列应用中使用金属材料的有 (填字母)。
(2) 化学小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如下实验方案: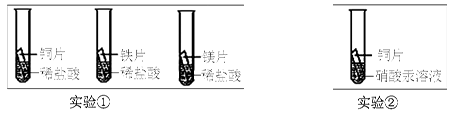
根据实验①判断出镁的金属活动性比铁强,依据的现象是 ;
根据实验②的现象得出的结论是 。
(3)化学小组收集到洗照片用过的硝酸银废液,利用废铁、废锌回收金属银。他们将金属混合物加入到硝酸银废液中,充分反应后过滤,得到固体和浅绿色溶液(忽略其他杂质),为了探究滤液中溶质的可能组成,他们做出以下猜想:
①溶质为硝酸锌 ②溶质为硝酸亚铁和硝酸银
③溶质为硝酸锌、硝酸亚铁 ④溶质为硝酸锌、硝酸亚铁、硝酸银
上述猜想中正确的是 。
(4)小组同学继续实验验证所得银粉固体中是否含有铁粉:
甲同学用简单的物理方法证明了固体中含有铁粉。他的方法是 ,
乙同学设计了如下测定固体中含银的质量分数的实验步骤:
A.取两药匙样品,加入过量稀硫酸;
B.待充分反应后,取出不溶物;
C.不溶物经洗涤、干燥后称量,记录其质量。
请回答:①步骤B中判断已充分反应的依据是 ,
②乙同学设计的实验方案能否达到实验目的,请说明理由 。
根据下图回答问题。
(1)实验室用装置A制取氧气时,所需药品是。
(2)实验室用装置B制取氧气时,反应的化学方程式为,收集该气体应选用。
(3)已知甲烷气体难溶于水,密度小于空气,若要收集干燥的甲烷气体,应选用的装置是。
A~F为初中化学常见物质,它们由H、C、O、Cl、Na、Ca中的元素组成。
(1)A为氧化物,可用于制备改良酸性土壤的碱,写出用A制备碱的化学方程式。
(2)B、C均为液体,且组成元素相同,C在一定条件下可生成B,B的化学式为。
(3)D用于玻璃、造纸、纺织、洗涤剂的生产。
取D溶液进行实验,操作及部分现象如图所示。D与F反应的化学方程式为。
(4)从上述物质中任选2种为一组,按下图装置进行实验,将液体滴入瓶中,关闭活塞。请根据表中现象,写出符合要求的物质。
| 现象 物质 |
气球变鼓,一段时间后恢复原状 |
气球变鼓,一段时间后不恢复原状 |
| 液体 |
||
| 固体 |
硅(Si)是太阳能电池和电脑芯片不可缺少的材料。利用石英砂(主要成分为二氧化硅)生产高纯硅的流程图如下(整个制备过程必须达到无水、无氧气)。
回答下列问题:
(1)该流程中无氧气的原因可能是。
(2)以上生产高纯硅的流程中,可循环使用的物质是。
阅读下面科普短文。
19世纪初,铝是比黄金还贵的金属,主要是由于铝的化学性质很活泼,在自然界以化合物形式存在。当时采用钠与氯化铝在一定条件下发生置换反应得到铝,因生产成本高,所以铝十分珍贵。
19世纪末,霍尔应用电解熔融金属化合物的方法制备金属。他在用氧化铝制备金属铝的过程中,发现氧化铝的熔点很高(2050℃),很难达到熔融状态,必须物色一种能够溶解氧化铝而又能降低其熔点的材料,实验过程中发现冰晶石(Na3AlF6)能起到这种作用。
霍尔在坩埚中,把氧化铝溶解在10%~15%的熔融的冰晶石里进行电解,发现有小球状银白色的铝生成,冰晶石在电解过程中不被分解,并有足够的流动性,有利于电解的进行。这种廉价炼铝方法的发现,使铝成为广泛应用的金属材料,至今仍在使用。
根据文章内容,回答下列问题:
(1)金属铝的物理性质。
(2)冰晶石中氟元素的化合价为。
(3)用金属钠制取铝的化学方程式为。
(4)霍尔用电解法制取铝的化学方程式为。
(5)电解法制铝的过程中,冰晶石的作用是。
根据下图回答下列问题。
(1)该配料表中,提供钙元素的物质中钙元素的质量分数为。
(2)服用该保健品后,有时会出现腹胀、打嗝等反应,出现这种反应的原因是(用化学方程式表示)。