某化工厂用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%。为测定该产品中含碳酸钠的质量分数,进行了以下实验:取12g纯碱样品放入烧杯中,称得烧杯及纯碱样品的总质量为158g,再把100g稀盐酸平均分成四份,依次加入到样品中,每次均充分反应。实验数据记录如下:
| 所加盐酸的次数 |
第一次 |
第二次 |
第三次 |
第四次 |
| 盐酸的质量/g |
25 |
25 |
25 |
25 |
| 烧杯及所盛物质总质量/g |
181.2 |
204.4 |
228.6 |
253.6 |
请计算:(要求计算过程)
(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量。
(2)该产品中碳酸钠的质量分数是否合格?
某化学兴趣小组为了粗略测定一批石灰石样品中CaCO3的质量分数,设计并进行如下实验。
实验装置如图所示,称取研细的2.60g石灰石样品,分4次加入稀盐酸,充分反应至不再产生气体为止。测得反应前后的有关质量如表: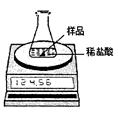
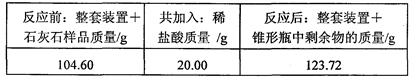
(1)计算石灰石样品中CaCO3的质量分数。
(2)若在上述实验过程中石灰石样品和所加酸液均无抛洒,根据图中装置判断,该实验结果可能(填“偏大”、“偏小”或“准确”),原因是。
某兴趣小组为探究“氧化铁和铜粉”混合物中铜的质量分数,称取一定质量的混合物,按照下图实验装置进行实验: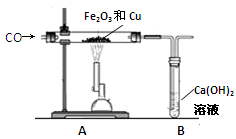
(1)实验时要“先通一氧化碳气体,后加热” 的目的是。
(2)装置A中发生反应的方程式为。
(3)实验装置B中的现象是,发生反应的化学方程式为。
(4)该装置的设计有一明显不当之处,你的改进方案是。
[定量分析]
该兴趣小组按照科学的方案完成实验后,对充分反应后的管内固体X进行如下后续实验探究: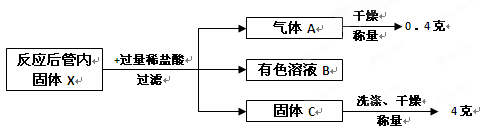
回答下列问题:
(1)写出固体X与稀盐酸反应的方程式:。
(2)有色溶液B中含有的溶质:(填化学式)。
(3)根据以上实验流程,计算原混合物“氧化铁和铜粉”中铜的质量分数为。
发射通信卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N2O4)助燃,生成物不会对大气造成污染。
(1)反应的化学方程式为2N2H4+N2O4=3__________+4H2O,请在横线上填写化学式以完成该化学方程式。
(2)请计算9.6gN2H4完全燃烧需要助燃物N2O4的质量。
2005年5月22日上午11时08分,中国登山测量队成功登上珠峰顶,这是继1975年后我国再次对珠穆朗玛峰高度进行精确测量。氢化钙(CaH2)固体是登山队员常用的能源提供剂,用它和水反应生成氢氧化钙和氢气:CaH2 + 2H2O = Ca(OH)2 + 2H2↑,氢气供燃烧之需。现有168g氢化钙与足量水反应,可生成多少克氢气?
工业上高温煅烧石灰石制取生石灰,发生反应的化学方程式为:CaCO3 CaO+CO2 ↑。若要制取2.8吨生石灰,至少需要含杂质10%(杂质不参加反应)的石灰石多少吨?(结果保留一位小数)
CaO+CO2 ↑。若要制取2.8吨生石灰,至少需要含杂质10%(杂质不参加反应)的石灰石多少吨?(结果保留一位小数)