某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使红色石蕊试纸变蓝。由该实验能得到的正确结论( )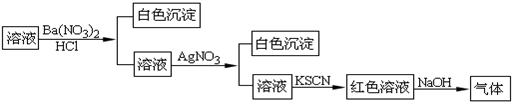
| A.原溶液中一定含有SO42-离子 | B.原溶液中一定含有NH4+离子 |
| C.原溶液中一定含有Cl-离子 | D.原溶液中一定含有Fe3+离子 |
在2SO2(g)+O2(g) 2SO3(g) 的平衡体系中,当分离出SO3时,下列说法中正确的是
2SO3(g) 的平衡体系中,当分离出SO3时,下列说法中正确的是
| A.正反应速率增大 | B.平衡向逆反应方向移动 |
| C.正反应速率大于逆反应速率 | D.逆反应速率一直减小 |
在密闭容器中充入0.5mol N2和1.5mol H2发生反应:N2(g)+3H2(g)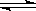 2NH3(g)ΔH ="-92.4" kJ?mol-1,充分反应后放出的热量为
2NH3(g)ΔH ="-92.4" kJ?mol-1,充分反应后放出的热量为
| A.等于92.4kJ | B.等于46.2kJ | C.大于46.2kJ | D.小于46.2kJ |
若将反应:Zn+H2SO4= ZnSO4+H2↑设计成原电池(装置如右),
则下列说法正确的是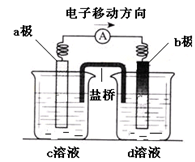
| A.d溶液是稀硫酸 |
| B.c溶液颜色变蓝 |
| C.b极发生氧化反应 |
| D.a极是铜棒 |
关于海带中提取碘实验,下列说法正确的是
| A.实验中包含溶解、过滤、升华等步骤 |
| B.加入过量的氯水将I-全部氧化成I2 |
| C.可以用CCl4直接将海带中的碘元素萃取出来 |
| D.将海带灼烧的目的是除掉其中的有机物,将碘元素转化为I- |
下列说法不正确的是
| A.明矾净水的原理是Al3+水解产生Al(OH)3胶体,Al(OH)3胶体能吸附水中的悬浮杂质,并使之沉降 |
| B.摩尔盐的制备原理为:6H2O+FeSO4+(NH4)2SO4=(NH4)2Fe(SO4)?6H2O,反应之所以能进行的原因是(NH4)2Fe(SO4)?6H2O溶解度最小 |
| C.镀锌铁皮在酸中溶解,当镀层反应完全时,产生氢气的速率会突然减慢 |
| D.将火柴头直接浸入品红溶液中,可以检验火柴头中是否含有硫元素 |