某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:
①该反应的气体产物是CO2;
②该反应的气体产物是CO;
③该反应的气体产物是 。
(2)计方案 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。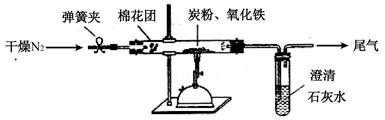
(3)查阅资料:
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式: 。
(4)实验步骤:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为 。
(5)数据处理:
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:
。
(6)实验优化:
学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 。
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善:
。
如右图所示,B中盛装的是一种固体物质。当A中的溶液滴入B内反应一段时间后,所得产物经装置C后可得到纯净的气体X,每个X分子中含有10个电子。D中盛装的是黑色粉末,当X气体通过D时,黑色粉末逐渐变成红色,最后从E装置中出来的气体是一种纯净的单质Y,Y在标准状况下的密度为1.25g/L。装置中A、B、C、D、E中的药品只能从下列所给试剂a~p中选择,图中某些夹持仪器未画出。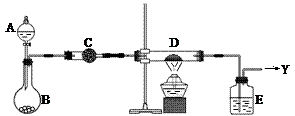
a.浓硫酸 b.浓硝酸 c.稀硝酸 d.浓盐酸 e.稀硫酸 f.浓氨水
g.铜片 h.锌片 i.碱石灰 j.硫酸铜 k.生石灰 l.硝酸铵晶体
m.固体烧碱 n.稀NaOH溶液 o.CuO p.MnO2
回答下列问题:
⑴C装置内的药品是(用a~p中的字母表示),其作用是。
⑵A中溶液和B中固体的所有可能的组合共有种。
⑶纯净气体X通过D时,发生反应的化学方程式是,反应中若转移电子的物质的量为1.2mol,则D装置中黑色固体共失重g。
⑷E中的药品是(用a~p中的字母表示),其作用是。
有机物A由C、H、O、Cl四种元素组成,其相对分子质量为198.5,Cl在侧链上。当A与Cl2分别在Fe作催化剂和光照条件下以物质的量之比为1:1反应时,分别是苯环上一氯取代有两种和侧链上一氯取代有一种;A与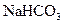 溶液反应时有气体放出。A经下列反应可逐步生成B~G。
溶液反应时有气体放出。A经下列反应可逐步生成B~G。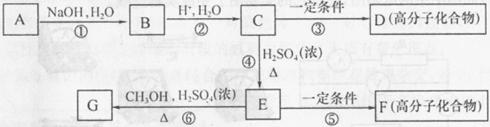
(1)A的分子式为________;D的结构简式为_________;
(2)上述反应中属于取代反应的是_________ (填编号);
(3)C中含氧官能团的名称为_______、________;
(4)E的同分异构体中,满足①苯环上只有一个侧链,且侧链上含有一个一CH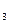 ;②能发生银镜反应;③属于酯类。则其结构简式为(写3种):
;②能发生银镜反应;③属于酯类。则其结构简式为(写3种):
________、________、________;
( 5)写化学方程式(有机物写结构简式):
5)写化学方程式(有机物写结构简式):
A与NaOH的醇溶液共热:______; E在一定条件下生成F:______。
某化学兴趣小组欲设计使用如下装置验证:
铜和一定量的浓硝酸反应有一氧化氮产生。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中的溶液体积变化)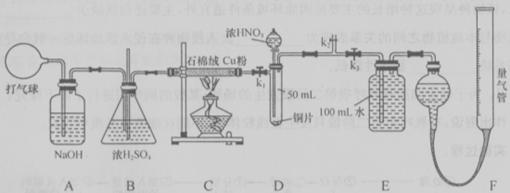
试回答下列问题:
(1)将铜粉分散在石棉绒中的原因是_________;
(2)在铜和浓硝酸反应前,挤压打气球,经A、B、C反应后,进入D中的气体是______(填化学式),通入该气体的目的是________;进行此步操作时应关闭_________,打开_________ (填k1、k2或k3);
(3)若C装置的硬质玻璃管中出现堵塞,则B中可能出现的现象是________;
(4)关闭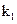 、
、 ,打开
,打开 ,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入
,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入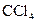 至满。则D中一定发生反应的离子方程式为:_________;
至满。则D中一定发生反应的离子方程式为:_________;
(5)若E中出现倒吸,可采取的应急操作是______;
研究某一化学反应的实验装置如下图所示:
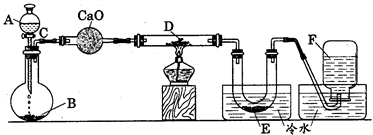 |
A~F属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氟水、水、锌粒、铜片、食盐、高锰酸钾、氯化钙、氧化钙、四氧化三铁、氧化铁、氧化铜、氢气、二氧化碳、二氧化氮、一氧化碳、氯气、氯化氢、氨气、氮气、氧气。
实验现象;
(1)D物质由黑色变为红色
(2)无水硫酸铜粉末放入无色透明的E中得到蓝色溶液
(3)点燃的镁条伸入无色无味的F中.镁条表面生成一种灰黄色固体物质。将该发黄色物质放入水中,有气体放出,该气体具有刺激性气味。并能使润湿的红色石蕊试纸变蓝。通过分析回答:
l、写出A~F的物质名称:
A,B,C,D,E,F。
2、写出有关的化学方程式:
A与B;
C与D;
E与无水硫酸铜;
F与Mg;
F与Mg的反应产物与水。
某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是、。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?
(填“能”或“否”),其原因是。
(3)他们记录的实验数据如下:
| 实验用品 |
溶液温度 |
中和热 △H |
|||
| t1 |
t2 |
||||
| ① |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.3℃ |
|
| ② |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.5℃ |
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果(填“有”或“无”)影响。