下列溶液中的c (Cl-)与100mL 1mol·L-1 氯化铝溶液中的c (Cl-)相等
| A.300ml 1mol·L-1氯化钠溶液 | B.150ml 2mol·L-1 氯化铵溶液 |
| C.75ml 3mol·L-1氯化钙溶液 | D.120ml 1.5mol·L-1氯化镁溶液 |
类推是化学研究中常用的一种思维方式,下列有关离子反应方程式的类推正确的是( )
| 已知 |
类推 |
|
| A |
向次氯酸钙溶液中通CO2气体: Ca2++2ClO-+CO2+H2O =CaCO3↓+2HClO |
向次氯酸钙溶液中通SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HclO |
| B |
用惰性电极电解硫酸 铜溶液:2Cu2++2H2O  2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
用铜电极电解硫酸铜溶液: 2Cu2++2H2O  2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| C |
稀硫酸与Ba(OH)2溶 液反应,pH=7时, 2H++SO42—+Ba2++2OH- =BaSO4↓+2H2O |
硫酸氢钠溶液与Ba(OH)2溶液反应, pH=7时,2H++SO42—+Ba2++2OH- =BaSO4↓+2H2O |
| D |
Ba(OH)2溶液逐滴滴入硫酸铝钾 溶液至沉淀质量达到最大值: 2Ba2++4OH-+Al3++2SO42— =2BaSO4↓+AlO2—+2H2O |
Ba(OH)2溶液逐滴滴入硫酸铝铵溶液至沉淀 质量达到最大值: 2Ba2++4OH-+Al3++2SO42—=2BaSO4↓+ AlO2—+2H2O |
常温下,某未知溶液中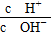 =1×1012,且含有大量Al3+和NO3—,检
=1×1012,且含有大量Al3+和NO3—,检
验此溶液中是否大量存在以下6种离子:①SiO32—、②NH4+、③Fe2+、④Na+、⑤HCO3—、⑥Cl-,其中不必检验就能加以否定的离子是( )
| A.①③⑤ | B.②③④ | C.①②⑥ | D.④⑤⑥ |
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
| 操作 |
现象 |
结论 |
|
| A |
滴加BaCl2溶液 |
生成白色沉淀 |
原溶液中有SO42— |
| B |
滴加氯水和CCl4,振荡、 静置 |
下层溶液显紫色 |
原溶液中有I- |
| C |
用洁净铂丝蘸取 溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+,无K+ |
| D |
滴加稀NaOH溶液,将湿 润的红色石蕊试纸 置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |
下列现象描述、化学方程式或离子方程式和反应类型都正确的是( )
| 选项 |
操作方法 |
主要现象 |
化学方程式或离子方程式 |
反应 类型 |
| A |
氢气在氯气中燃烧 |
蓝色 火焰 |
H2+Cl2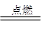 2HCl 2HCl |
化合 反应 |
| B |
SO2通入硝酸 钡溶液中 |
产生白色沉淀 |
Ba(NO3)2+SO2+H2O= BaSO3↓+2HNO3 |
复分解反应 |
| C |
常温下,足量 的Cl2通入 FeBr2溶液中 |
浅绿色变黄色 |
2Fe2++Cl2=2Fe3++2Cl- |
氧化还原反应 |
| D |
硫化氢通 入碘水中 |
颜色变浅产生 淡黄色固体 |
H2S+I2=S↓+2HI |
氧化还原反应 |
欲将混合液中Al3+、Cu2+、Ba2+、Ag+逐一沉淀出来加以分离,加入试剂①Cl- ②SO42—
③OH- ④CO2⑤CO32—的正确顺序是( )
| A.①②③④ | B.③⑤①② |
| C.②①③⑤ | D.①⑤③② |