金属的应用非常广泛。
(1)生活中常用铁锅炒菜,主要利用了铁的性质是(填序号) 。
A.导热性 B.导电性 C.延展性 D.有金属光泽
(2)下列能与铁发生反应的是(填序号) 。
A.氧气 B.稀盐酸 C.硫酸铜溶液 D.氯化锌溶液
(3)工业上,常在高温下用一氧化碳把铁从铁矿石中还原出来。若用磁铁矿(主要成分为四氧化三铁)冶炼铁,写出发生反应的化学方程式 。一些铁制品容易生锈。铁制品生锈的条件是 。
(4)某同学在探究金属活动性时做了下列实验:将一条铝片伸入盛有硫酸铜溶液的试管中,开始时没有明显现象,一段时间后,铝片的表面有气泡出现,且有红色固体生成。为了解释此“反常”现象,他查阅资料得知:配制硫酸铜溶液时常加入少量稀硫酸。上述实验中共发生了 个反应,其中产生红色固体物质的化学反应方程式是 。
(5)若向铜和稀硫酸的混合物中滴加过氧化氢溶液,只观察到溶液颜色变蓝,发生反应的化学方程式为 。
火药是我国古代四大发明之一.火药由硫磺、硝石、木炭三种物质按一定质量比混合而成.
请回答下列问题:
(1)火药属于 (填"纯净物"或"混合物").
(2)已知某种配比的火药,在空气中燃烧的化学方程式如下:
S+2KNO 3+3C 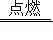 K 2S+N 2↑+3X↑,则X的化学式为 .
K 2S+N 2↑+3X↑,则X的化学式为 .
(3)硝石的主要成分为硝酸钾,硝酸钾在现代农业上有重要用途,它能给农作物提供 和 两种营养元素.
(4)硫磺的主要成分为硫,硫在空气中燃烧产生 火焰;其生成的二氧化硫是形成 的主要物质(填"酸雨"或"臭氧空洞").
(5)木炭是我国古代炼铁的重要原料(作燃料和还原性物质),试写出其与氧化铁高温反应制铁的化学方程式 .
如图为A,B,C三种固体物质在水中的溶解度曲线,据此回答下列问题:
(1)T1℃时,在100克水中最多溶解 克A。
(2)T2℃时,A和B两种固体物质的溶解度 (填“相同”或“不同”)。
(3)三种物质中 溶解度随温度升高而减小。
某元素是人体中的常见元素,该元素在人体内99%存在于骨骼和牙齿中,其原子结构示意图为  ,该元素的原子序数为 ,原子核外有 个电子层;该元素属于 (填"金属"和"非金属")元素,该元素原子失去最外层电子所形成的离子为 (用离子符号表示).
,该元素的原子序数为 ,原子核外有 个电子层;该元素属于 (填"金属"和"非金属")元素,该元素原子失去最外层电子所形成的离子为 (用离子符号表示).
化学就在我们身边.请从下列物质中选择适当的物质填空.(填字母序号)
| A. |
CH 4 |
B. |
维生素A |
C. |
生石灰 |
D. |
活性炭 |
E. |
葡萄糖 |
F. |
食盐 |
(1)可用作食品干燥剂的是 .
(2)能为人体提供能量的是 .
(3)最简单的有机物是 .
(4)常用于冰箱内除异味的物质是 .
(5)常用作厨房调味品的是 .
(6)人体内缺乏会导致人患夜盲症的是 .
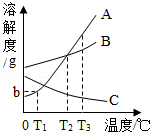
根据图中A、B、C三种固体的溶解度曲线回答:
(1)在某一温度时,A、B两饱和溶液的溶质质量分数相等,此温度为 ℃;
(2)在t3℃时,将30gA物质充分溶解在50g水中,所得溶液的质量为 g;
(3)要使C的饱和溶液变为不饱和溶液,可采用的一种方法是 ;
(4)将t3℃的A、B、C三种物质的饱和溶液分别降温到t1℃时,所得溶液的溶质质量分数由大到小的顺序是 .