某同学在查阅资料时得知:市售纯碱样品常混有氯化钠杂质。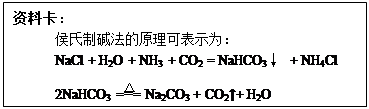
该同学设计了如下图中的装置进行实验,测定市售纯碱样品中碳酸钠的质量分数。(水蒸气的影响忽略不计,夹持装置已略去)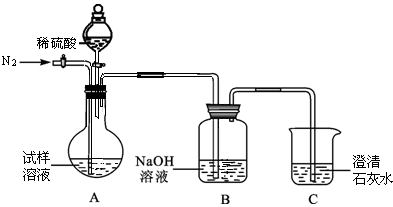
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②称量5.5 g市售纯碱样品放入烧瓶中,加适量蒸馏水溶解,得到试样溶液;
③从分液漏斗滴入稀硫酸,直到不再产生气体时为止;
④缓缓鼓入一定量的N2;
⑤称量B瓶及溶液的质量,发现增重2.2 g。
请回答下列问题:
(1)写出A中发生反应的化学方程式 。
(2)鼓入一定量的N2的目的是 。装置C中澄清石灰水的作用是 。
(3)如果将分液漏斗中的稀硫酸换成浓盐酸,测试的结果(填偏高、偏低或不变) 。
(4)该样品中碳酸钠的质量分数为 %(结果保留到小数点后一位)。
(5)若用与上述实验反应原理不同的实验来测定纯碱样品中碳酸钠的质量分数,请用化学方程式表示实验原理 。
某工厂需要280g生石灰( )作干燥剂,需要碳酸钙的质量是多少?至少需要含碳酸钙80%的石灰石(杂质不参加反应)的质量是多少?( )
某纯碱样品中含有杂质
,为测定该样品中
的质量分数,称取纯碱样品
,放入
水中使其完全溶解,再加入稀盐酸
,恰好完全反应,反应后溶液的总质量为
。
试计算:(写出计算过程,结果保留一位小数)
(1)生成二氧化碳的质量;
(2)样品中
的质量分数;
(3)反应后所得溶液中溶质的质量分数。
小宁需要配制80g质量分数为10%的氢氧化钠溶液来制作"叶脉书签".如图是配制该氢氧化钠溶液的实验操作示意图.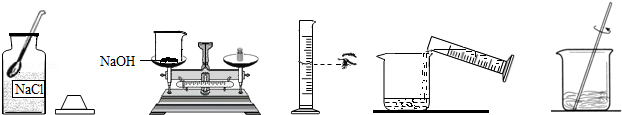
【实验步骤】
(1)计算:需要氢氧化钠固体g,水mL(水的密度以1.0g/cm3计)
(2)称量:用托盘天平称取氢氧化钠固体,用规格为(填"10mL"、"50mL"或"100mL")的量筒取所需要的水,倒入盛有氢氧化钠的烧杯中.
(3)溶解:用玻璃棒搅拌,使氢氧化钠固体完全溶解.
【拓展思维】
假如小宁想用上述配制的氢氧化钠溶液完全中和溶质质量分数为10%的盐酸,至少消耗盐酸的质量是多少?(反应的化学方程式为:
)
在工业制取硫酸的过程中,有发生如下反应: .现有含 60%的黄铁矿100 (假设杂质不参加反应),最多可生产 多少吨?(相对分子质量: ﹣120 ﹣64)
山梨酸钾是常用食品防腐剂,化学式为
,相对分子质量为150.
(1)山梨酸钾由种元素组成;
(2)60
山梨酸钾中含钾元素的质量
.