向Cr2(SO4)3的水溶液中加入NaOH溶液,当pH =4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多;但当pH>13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO22-)。其平衡关系如下:
Cr3++3OH- Cr(OH)3
Cr(OH)3 CrO22- + H+ + H2O
CrO22- + H+ + H2O
(紫色) (灰绿色) (亮绿色)
向0. 05mo1·L-1 Cr2(SO4)3溶液50mL中,加入1.0mol·L-1NaOH溶液50mL,充分反应后,溶液中可观察到的现象是 (lg2=0.3) ( )
| A.溶液为紫色 | B.溶液中有灰绿色沉淀 |
| C.溶液为亮绿色 | D.无法判断 |
已知热化学方程式:①CO(g) + 1/2O2(g)=CO2(g)ΔH=--283.0kJ·mol-1
②H2(g) +1/2O2(g)=H2O(g)ΔH=--241.8 kJ·mol-1
则下列说法正确的是()
| A.H2的燃烧热为241.8kJ·mol-1 |
| B.由反应①、②可知上图所示的热化学方程式为 CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=--41.2 kJ·mol-1 |
| C.H2(g)转变成H2O(g)的化学反应一定要释放能量 |
| D.根据②推知反应H2(g)+1/2O2(g)=H2O(l)ΔH>--241.8 kJ·mol-1 |
已知常温时红磷比白磷稳定,在下列反应中
P4(白磷,s)+5O2(g)====2P2O5(s)△H=-a kJ/mol
4P(红磷,s)+5O2(g)====2P2O5(s)△H=-b kJ/mol
若a、b均大于零,则a和b的关系为( )
A.a<b B.a>b C.a=b D.无法确定
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为( )
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是285.8 kJ·mol-1、1411.0 kJ·mol-1和1366.8 kJ mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为()
| A.--44.2 kJ·mol-1 | B.+44.2 kJ·mol-1 | C.--330 kJ·mol-1 | D.+330 kJ·mol-1 |
某学生用如图所示装置进行化学反应X+2Y===2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到导管中甲处液面下降,乙处液面上升。关于该反应的叙述正确的是( )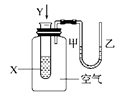
①该反应为放热反应 ②生成物的总能量比反应物的总能量高 ③该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来
| A.①②③ | B.①③ | C.①② | D.② |